PS. 基因转染世界复杂而神秘。东纳生物现提供免费的MagTransfTM磁转染试剂试用装,欢迎各位学者与我们一起探究基因转染的世界,详细信息请来函来电咨询。
五步解析 磁转染,深挖细节增效率
1952年,美国遗传学家阿尔弗雷德·赫尔希(Alfred DayHershey)和玛莎·蔡斯(Martha Cowles Chase)让全世界认识了携带遗传信息的DNA,掀开了基因时代的篇章。半个世纪过去了,基因测序技术发展的如火如荼,而基因转染技术乃至于基因治疗技术仍在摸爬滚打中艰难前行。
基因转染是将特定的遗传信息传递到真核细胞中的技术,需要携带信息的DNA及转染试剂。常规基因转染分为病毒载体法(生物学方法)及非病毒载体法(非生物学方法)。目前,转染效率最高的是病毒,但病毒的毒性及免疫原性大大提高了其研究难度。非病毒载体,如阳离子脂质体、聚合物、纳米磁珠等,虽然由于不具备病毒跨越细胞内障碍的能力,但其具有生物相容性好、可以大量生产的优势,所以该类载体成为研究的热点,其研究的重点就是提高转染效率。
首先我们来认识下基因转染的过程。
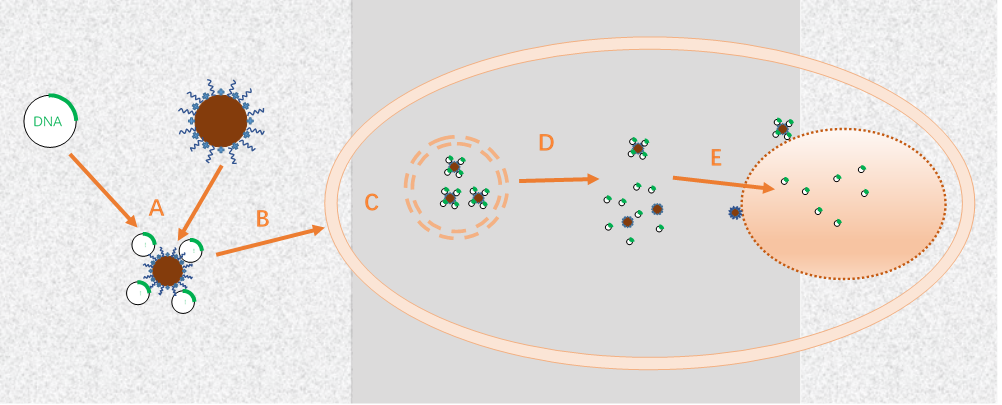
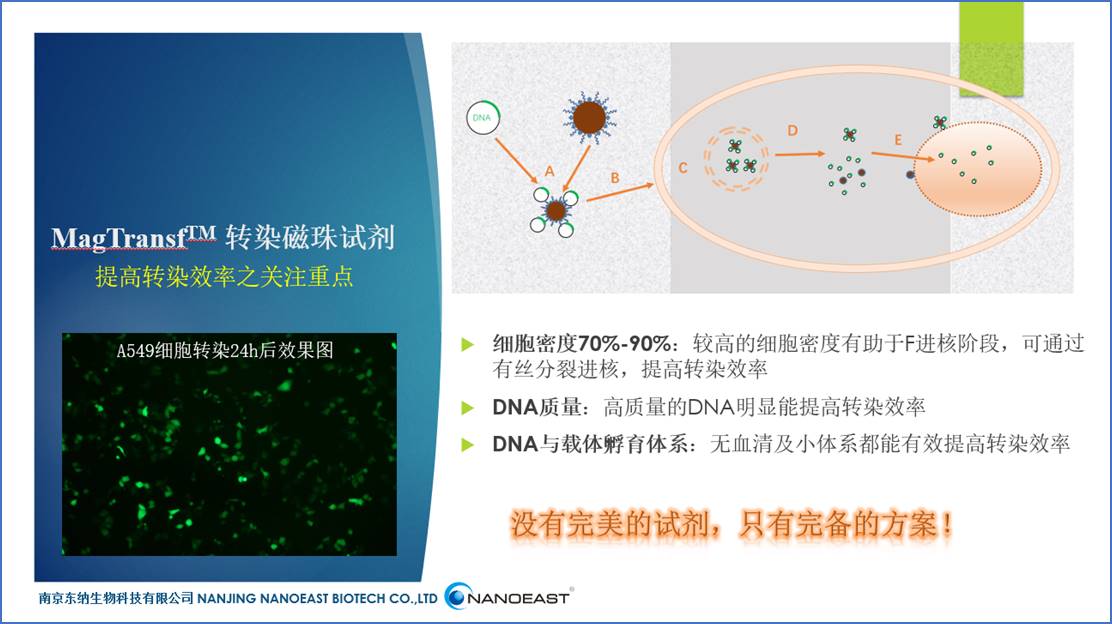
图1 转染过程简图[1]
A:携带信息的DNA与转染试剂形成复合物。转染试剂的选择、缓冲液、pH、投料比、反应浓度都会影响最后复合物的大小及稳定性,进而影响之后的转染效率。东纳生物的MagTransfTM磁转染磁珠表面修饰经过优选的阳离子聚合物,携带合适的正电荷,与负电荷的DNA通过静电作用结合形成稳定的复合物,同时MagTransfTM表面还修饰有生物相容性高分子,以提高复合物的稳定性,并降低其毒性。
B:DNA与转染试剂的复合物靠近细胞膜。在这一过程中MagTransfTM因具备磁性,在磁场作用下快速沉降富集到细胞表面,复合物依靠静电作用与电负性的细胞膜结合。MagTransfTM内核是经过优选的具有超顺磁性的纳米级磁珠,生物相容性优良,具有良好的分散性和胶体稳定性。
C:复合物被细胞内吞。内吞过程包括各种不同的途径,这些不同的途径可能影响生物活性分子向细胞质及细胞核的运输。内吞泡的尺寸及细胞机制将细胞内吞分为以下三种类型:噬菌作用,吞入大小为0.25-10 μm的大颗粒;胞饮作用,内吞吸附在细胞膜上的大分子或颗粒物质;受体介导内吞,被内吞物为配体可与细胞表面的专一受体相结合引发内吞。这一过程中复合体的尺寸可能会影响细胞内吞的途径,进而影响转染效率。
D:溶酶体逃逸。由于溶酶体的pH值(5.0-6.2)较细胞质低(7.4)。因此,只有避免溶酶体、内吞体降解才能有效的提高转染效率。而MagTransfTM表面阳离子聚合物因其“质子海绵效应”,当溶酶体内的pH下降时,能够大量捕获质子,并引起氯离子内流,导致溶酶体渗透性肿胀,最后溶酶体破裂从而将内吞的复合物释放到细胞质中,同时,阳离子聚合物能够保护DNA不被细胞质内的酶降解。
E:DNA进入细胞核。必须将DNA递送到细胞核中以进入转录机制,所以DNA的核吸收是转染的关键步骤。受核孔复合体(NPC)尺寸的限制,分子小于50kDa可以通过被动扩散自由地穿过NPC,但研究也发现载体DNA复合物可以在有丝分裂的时候进入细胞核[3],很多研究也证明细胞核内出现载体,同时也有研究认为载体携带的DNA有核定位功能,这些途径都有助于成功实现DNA转染。
上面我们简单介绍了转染试剂负载DNA进行转染的过程,各个环节都会影响转染的效果,那我们选择合适的转染试剂就能提高转染效率了吗,答案是没那么简单,下面我们将以东纳生物的MagTransfTM磁转染试剂为例讲讲转染操作步骤中可以提高转染效率的地方(以24孔贴壁细胞为例,其他培养皿按比例添加)。
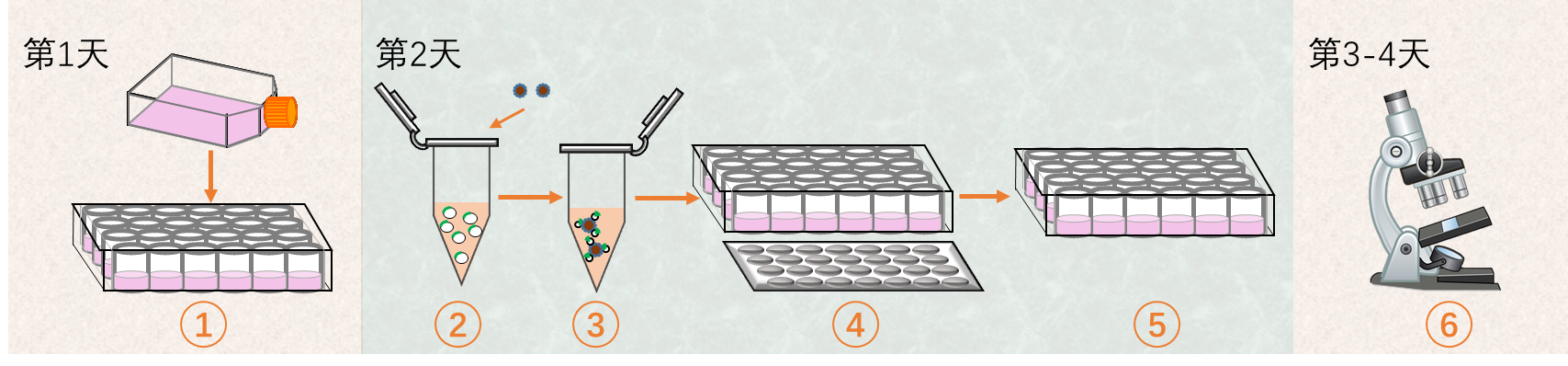
图2 MagTransfTM磁转染过程简图
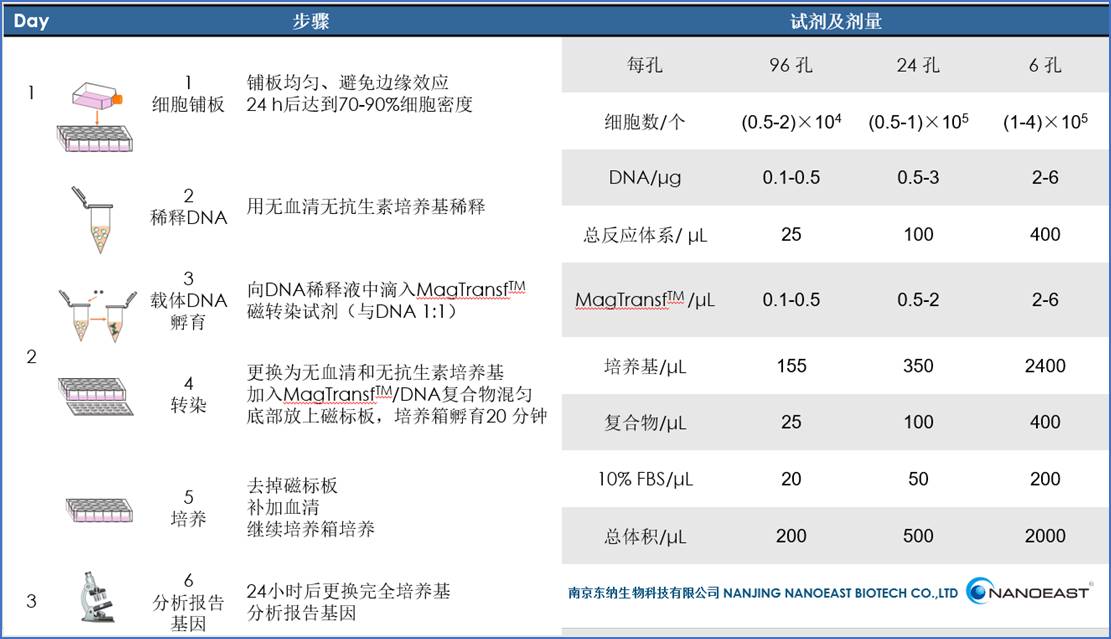
1. 细胞铺板:准备细胞0.5-2×105个细胞/500 μL,铺板时注意边缘效应。
a) 先用培养基润湿培养皿后吸去培养基,避免细胞滴加的不均匀性。
b) 不同位置滴加细胞悬液,均匀铺满培养皿。
c) 8字混匀后在工作台静置1-2小时,直接进入培养箱会因温度的变化引起边缘效应,所以先让细胞自然沉降在培养皿底部后再放入培养箱中培养。
d) 24小时后观察细胞密度,达到70-90%时转染效果较好。
2.DNA稀释:
a) 选用高质量的DNA 1 μg(单孔)。如果自己提取DNA,建议使用去内毒素的质粒大提试剂盒提取,尽量获得较高浓度的DNA,且无RNA污染,OD260/OD280大于1.8且小于2。
b) 使用无血清和无抗生素的培养基稀释DNA,因为血清和抗生素可能会影响DNA与磁珠复合物形成。DNA稀释后的反应浓度建议为10 μg/mL,或者更高,部分研究认为高反应浓度形成的复合物能有效的提高转染效率[2]。
3.复合物孵育:取1 μL MagTransfTM磁转染试剂(单孔),滴加入DNA稀释液中,轻轻混匀,超净工作台静置20分钟。
笔者认为这一步很关键,不同的混合方式影响了形成复合物的大小及其空间结构,而不同的复合物大小及空间结构可能导致不同细胞内吞途径,也许大的复合物可以不通过溶酶体而直接进入细胞质,反而有助于接近细胞核。关于复合物大小对转染效率的影响的研究很多,但都未得到统一的认知,复合物的尺寸也许因细胞而异。
4. 转染:
a) 细胞密度达到80%左右后,吸去上清,用PBS清洗细胞,加入一定体积的无血清无抗生素的培养基。
b) 将复合物不同位置滴加入细胞培养皿中,8字混匀,底部放上磁标板,放入CO2培养箱转染20分钟。
5. 培养:从培养箱中取出培养板,撤掉磁标板,根据细胞培养要求补加血清,然后放入CO2培养箱继续培养。
6. 更换培养基及分析:细胞培养24小时后可更换为完全培养基,并可分析报告基因。
另外,MagTransfTM纳米磁转染载体表面阳离子聚合物与生物相容性高分子共修饰策略,大大增加了磁转染载体负载基因后的分散性、胶体稳定性以及生物相容性,可以通过静脉注射进行体内基因递送研究,同时磁性纳米颗粒还提供了磁共振成像示踪的功能,这将进一步拓展你的研究工作。
MagTransfTM磁转染试剂介绍:
参考文献:
[1] Luo D , Saltzman W M . Synthetic DNA delivery systems. Nature Biotechnology, 2000, 18(1):33-37.
[2] Zhang W, Kang X, Yuan B, et al. Nano-Structural Effects on Gene Transfection: Large, Botryoid-Shaped Nanoparticles Enhance DNA Delivery via Macropinocytosis and Effective Dissociation. Theranostics. 2019;9(6):1580–1598.
[3] Bai H, Lester GMS, Petishnok LC, Dean DA. Cytoplasmic transport and nuclear import of plasmid DNA. Biosci Rep. 2017;37(6):
“助力科研创新,帮助客户成功”