磁纳米诊疗技术是基于磁性纳米材料的生物相容性和多功能理化与生物特性,如超顺磁性、磁响应性、磁热效应、纳米酶效应等,通过控制纳米材料的尺寸、表面、成分、组装等纳米特征参数并利用all in one的思路,将成像、治疗、载药与磁控制进行有机整合,同时还可以引入生物、光学、声学等协同功能的其他组件,从而构建多靶标、多模态、多功能、可操控的纳米诊疗平台,为肿瘤、心脑血管等疾病的诊断和治疗提供强有力的新方法和新技术。
基于氧化铁纳米颗粒的磁感应热疗已被用于临床复发性胶质瘤的辅助治疗,但是这种治疗仅局限于瘤内注射,经静脉注射的肿瘤靶向磁感应热疗仍然面临大的挑战。为了达到肿瘤的治疗温度,氧化铁纳米颗粒需要产生足够的热量:首先,要有足够数量的纳米颗粒聚集到靶向部位;其次,要在安全的交变磁场下进行热疗。依赖于肿瘤EPR效应的被动靶向是目前体内药物递送的主要方式,但是由于EPR效应的异质性,纳米治疗剂在瘤内的分布差异巨大,且瘤内的累积量有限。双靶向纳米探针的构建在被动靶向基础上,针对血管内皮和肿瘤细胞表面的广谱靶点,可以进一步的增加成像的敏感性,且在肿瘤内具有更强的渗透能力。磁靶向是另一种有效的靶向策略,可以驱动血管内的磁性颗粒深入靶向到肿瘤内部。
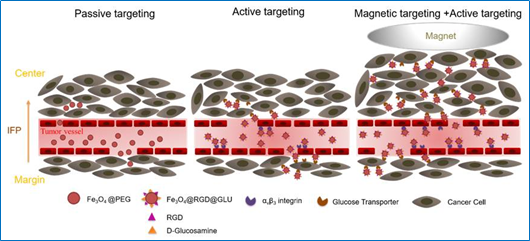
图1. 在被动靶向(EPR效应)基础上主动靶向联合磁驱动实现磁性纳米探针深入肿瘤内部
为此,来自东南大学生物科学与医学工程学院的研究者构建了一种具有广谱性的双特异磁性纳米探针,并采用主动靶向和磁靶向联合的靶向策略,从而实现有效的肿瘤磁共振成像和磁感应热疗。这种带有双配体(环RGD与葡萄糖)的磁性氧化铁纳米探针(Fe3O4@RGD@GLU)可以同时靶向到肿瘤血管内皮特异性表达的αvβ3整合素和肿瘤细胞表面高表达的葡萄糖转运蛋白。我们比较了三种不同靶向策略下的肿瘤磁共振对比成像效果和肿瘤磁热治疗效果,分别是被动靶向、主动靶向、主动靶向联合磁靶向,成像和抑瘤效果一致显示主动靶向结合磁靶向的联合靶向策略获得了最佳的肿瘤成像和治疗效果。体内生物分布实验也证实,联合靶向策略下,肿瘤组织内的氧化铁纳米颗粒的累积量达到最大。并且,在磁力作用下纳米探针可以渗透到肿瘤组织的深部,促进肿瘤热疗效果。这种双靶向的纳米探针有望作为对比剂和治疗剂用于静脉注射,实现联合靶向模式下的肿瘤磁共振成像和磁感应热疗。
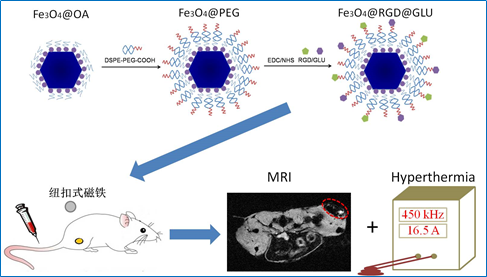
图2. 磁性氧化铁纳米颗粒的表面PEG化和靶向配体修饰,以及主动靶向联合磁靶向实现磁共振成像与磁感应热疗
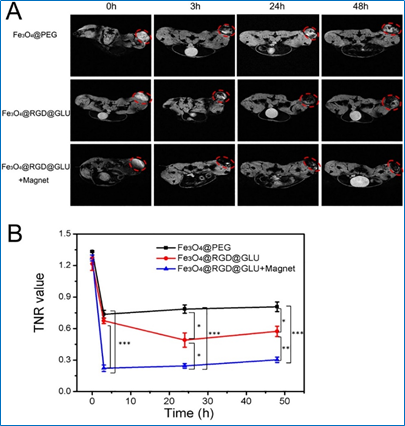
图3. 相对于被动靶向、主动靶向,双主动靶向联合磁靶向具有更好的磁共振成像效果
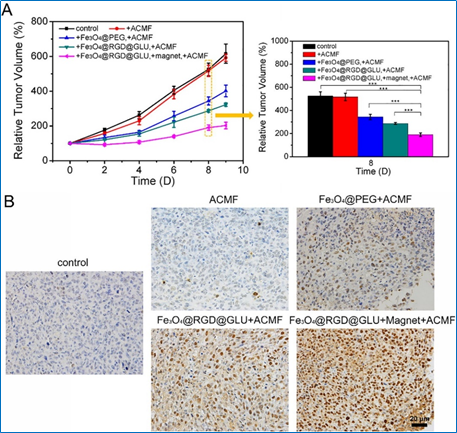
图4. 相对于被动靶向、主动靶向,双主动靶向联合磁靶向具有更好磁感应肿瘤热疗效果(B图为组织TUNEL染色)
该项研究工作已经发表在国际期刊Acta Biomaterialia上,陈玲和吴旸博士是该论文的共同第一作者,东南大学生物医学纳米技术研究组的顾宁和张宇教授是论文的共同通讯作者。Ling Chen,Yang Wu,Haoan Wu,Jianzhong Li,Jun Xie,Fengchao Zang,Ming Ma,Ning Gu*,Yu Zhang*, Magnetic targeting combined withactive targeting of dual-ligand iron oxide nanoprobes to promote thepenetration depth in tumors for effective magnetic resonance imaging and hyperthermia,Acta Biomaterialia, 2019, 96, 491-504