
文章链接
 Catalytic gold–platinum alloy nanoparticles and a novel glucose oxidase mimic with enhanced activity and selectivity constructed by molecular imprinting.pdf
Catalytic gold–platinum alloy nanoparticles and a novel glucose oxidase mimic with enhanced activity and selectivity constructed by molecular imprinting.pdf
葡萄糖(Glu)在各种生理活动中起着至关重要的作用,因此Glu的催化氧化及检测具有很高的研究和应用价值。而金纳米颗粒(AuNPs)可用作葡萄糖氧化酶(GOD)模拟物,AuNPs催化Glu氧化在工业生产、科学研究和生物医学检测中有着广泛应用。尽管AuNPs具有竞争优势,但缺乏选择性和有限的催化能力一直制约着AuNPs的进一步应用。

近日,东南大学生物科学与医学工程学院的研究团队构建了具有选择性与更高催化活性的金基模拟酶。他们通过表面涂层和掺杂其他金属来提高AuNPs的类GOD活性。研究者为研究掺杂不同元素对类GOD活性的影响,制备了四种不同柠檬酸盐修饰的Au-Pt和Au-Ag摩尔比为1:1的金基纳米颗粒,并以柠檬酸钠-鞣酸法制备的10nmAuNPs作为对照。用ABTS法检测了金基纳米酶催化Glu的氧化反应。对Glu浓度依赖性研究表明,所有金基纳米酶催化的Glu氧化反应在实验浓度范围内呈现逐渐增加的趋势。与平均粒径为10nm的AuNPs相比,粒径在10nm左右的金基掺杂纳米颗粒均能显著提高催化活性。其中Au-Pt合金纳米颗粒最大提高了类GOD活性。Au core-Ag shell纳米颗粒在金核外形成了致密的Ag壳层,紧密的包覆在金核表面。在Au core-Pt shell纳米颗粒中,金核主要与周围铂簇吸附。铂壳层的疏松结构和铂壳层与金核的不紧密结合,可能增加与基底的接触,也可能导致铂壳层的尺寸增大,分散性和均匀性降低。结果表明,在相同的10nm金核条件下,Au@Ag的性能优于Au@Pt。催化活性的不同不仅是由于元素组成的不同,还可能是由于结构的不同。
接下来研究者制备了Au-Pt摩尔比为3:1-1:3的金铂合金颗粒(AuPtNPs),以进一步探索增强类GOD活性的金基纳米颗粒。与10nm AuNPs相比,不同掺杂比例的AuPtNPs表现出明显的类GOD活性改善。纳米材料催化性能受多种内在因素的影响,如元素组成、粒径、形态和表面改性阳离子等。从粒径来看,纳米材料的催化活性明显随粒径的增大而减小。形状相似、尺寸较小的AuPtNPs具有更大的比表面积,因而具有更高的催化活性。铂掺杂比例的增加将导致类GOD活性的增强,并导致尺寸的增大。结果表明,Au-Pt摩尔比适中、粒径较小的AuPtNPs(1:1)具有最高的催化活性。AuPtNPs(1:3)由于尺寸过大而表现最差,并且平均直径最小的AuPtNPs(3:1)的催化活性受低活性元素限制。忽略尺寸的影响,AuPtNPs单位面积的类GOD活性随Pt掺杂比的增加而增加。
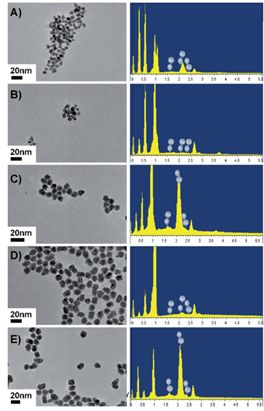
图1 不同Au-Pt摩尔比AuPtNPs的TEM图像和EDX结果。(A)AuPtNPs(3:1),(B)AuPtNPs(2:1),(C)AuPtNPs(1:1),(D)AuPtNPs(1:2)和(E)AuPtNPs(1:3)
由于金基纳米酶缺乏选择性,研究者引入了分子印迹技术,构建了具有增强活性和Glu特异性选择性的纳米酶MIP(AuPt)。以类GOD活性最高的AuPtNPs(1:1)为催化中心,MMs(磁性微球)作为支持物,将AuPtNPs(1:1)修饰在磁性微球表面已形成大量的纳米酶催化中心(AuPt-MM)。根据计算,单个磁性微球上AuPtNPs(1:1)的平均数量约为5804个。氨基苯硼酸(APBA)作为识别分子和聚合单体,通过静电吸附以及Au原子与APBA胺基之间的N–Au键吸附在AuPtNPs上。因为APBA可以在碱性或中性条件下与糖的相邻羟基结合,Glu作为模板分子在无氧条件下与APBA修饰的AuPt-MM结合。此外,反应性氨基可以引发APBA的聚合。在交联剂存在下,形成APBA的聚合网络结构(pAPBA),并以薄壳层的形式沉积在AuPt-MM表面。
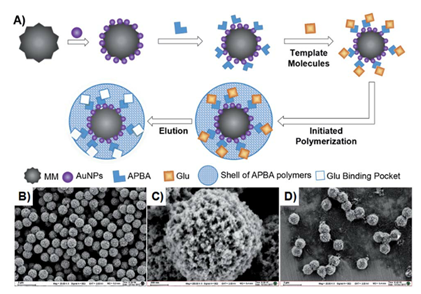
图2 MIP(AuPt)的构建。(A)基于AuPtNPs的GOD模拟原理,通过分子印迹构建了具有增强催化活性和选择性的GOD模拟物。(B)裸MMs,(C)AuPtNP(1:1)修饰MMs和(D)MIP(AuPt)的扫描电镜图像(其中1um磁性微球来自南京东纳生物科技有限公司)
由于APBA的硼酸基团与Glu相邻羟基之间的共价键在酸性条件下可以打开,模板分子用酸性磷酸盐缓冲液洗脱,从而形成具有特异性Glu结合口袋的分子印迹聚合物壳。结果表明,分子印迹的引入对催化活性有显著的改善。多孔分子印迹的APBA聚合物壳增强了对底物的亲和力,并提供了更多的结合位点和特异性结合口袋来捕获和富集Glu在活性中心周围。与10nm AuNPs相比,AuPtNPs(1:1)和MIP(AuPt)的催化效率分别提高了约3倍和200倍,且MIP具有较高的葡萄糖选择性。
MIP(AuPt)由于MMs的引入可以进行磁分离,重复使用3次,其回收率为95.55%。磁性微球载体赋予了纳米酶可分离、可操作、可重复使用的功能,在未来的分离纯化、富集检测中将发挥重要的作用。
由于AuPtNPs(1:1)和MIP(AuPt)具有良好的催化性能,在实际食品分析中得到了成功的应用。以GOD、AuPtNPs(1:1)和MIP(AuPt)为催化剂,对华生矿泉水、可口可乐、七喜和瓶装雀巢进行了测试。根据已知浓度Glu溶液的标准曲线,用UV-vis吸收值计算不同饮料中Glu的浓度,金基纳米酶的结果相似,与GOD无显著统计学差异,表面基于磁性微球和AuPtNPs的分子印迹结构纳米酶可以有效实现葡萄糖的特异性检测。
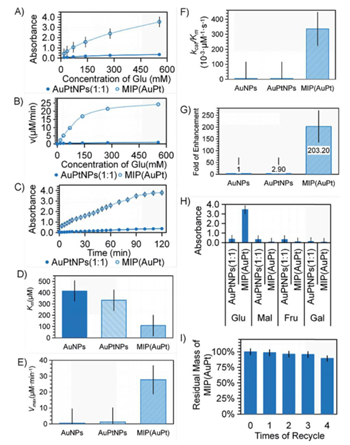
图3 AuPtNPs(1:1)和MIP(AuPt)的催化性能。(a)Glu浓度依赖性,(b)酶动力学和(c)AuPtNP(1∶1)和MIP(AuPt)催化的Glu氧化的时间依赖性。(d)Km,(e)Vmax,(f)催化效率(KCAT/Km)(g)催化效率提高:10nm AuNP,AuPtNP(1∶1)和MIP(AuPt)催化的Glu氧化。(H)以556.56mM Glu、Mal、Fru和Gal为底物的MIP(AuPt)特异性研究。(I) MIP(AuPt)的磁回收再利用研究
研究者合成了各种金纳米结构以改善AuNPs氧化酶活性,AuPt合金纳米颗粒中Au-Pt摩尔比为1∶1的样品,由于尺寸和元素组成的共同作用,发现其具有最高的催化活性。以APBA为识别分子和聚合物单体,以AuPtNPs 为催化中心,采用分子印迹技术构建了一种具有底物选择性、催化活性比10nm AuNPs高200倍的磁性分子印迹结构的纳米酶。综合考虑成本和稳定性,掺杂其它元素是充分利用AuNPs的优点,提高纳米酶催化活性的有效方法。这种纳米酶活性的显著提高不仅与底物选择性、亲和性的改善有关,而且与磁性微球表面多孔结构的分子印迹层有关,其多孔结构可能通过空间限域催化效应进一步提升催化效率。此外,具有催化活性和底物选择性的磁性微球纳米酶在理论研究和实际应用中将具有巨大的潜力,如可回收生物催化、分子靶标富集与检测、纳米酶磁操纵等。
这一成果近期以“Catalytic gold–platinum alloy nanoparticles and a novel glucose oxidase mimic with enhanced activity and selectivity constructed by molecular imprinting”为名发表于《Analytical Methods》(2019, 11, 4586–4592)上。文章的第一作者为东南大学范霖博士,通讯作者为东南大学张宇教授与顾宁教授。