
点击阅读原文
面对持续发展的新冠肺炎疫情,作为预防、控制甚至消灭传染病最为有效的方法,新冠肺炎疫苗的研发工作也在各界科研和医护人员的努力下紧锣密鼓的推进中。NanoEast作为生物医学纳米材料应用技术专家,本着为新冠肺炎疫苗的研发贡献微薄力量的初心,对生物可降解聚合物纳米材料作为疫苗载体或佐剂在开发更安全、更有效疫苗的应用潜力将进行系列介绍,以助力新冠肺炎疫苗研发成功。
载体/佐剂于疫苗的作用
从研发技术上,可将疫苗分成传统疫苗和新型疫苗。传统疫苗即采用病原微生物及其代谢产物,经过人工减毒、脱毒、灭活等方法制成的疫苗,包括灭活疫苗、减毒活疫苗。新型疫苗主要是指使用基因工程技术生产的疫苗,包括基因工程亚单位疫苗、基因工程载体疫苗、核酸疫苗、基因缺失疫苗等。与传统疫苗相比,新型疫苗具有稳定性好、持续时间长、抗原用量少等优点。此外,新型疫苗具有更好的免疫效果和更低的毒性副作用。
然而,无论是新型疫苗还是传统疫苗都需要应用安全有效的佐剂和载体诱导人体产生更强、更持续的免疫应答,其中佐剂是加入疫苗中以增加免疫应答反应的物质,疫苗载体则可以将抗原传递至体内靶细胞以提高抗原的利用率。
近年来,纳米技术在新型疫苗佐剂和纳米给药系统的开发中发挥了重要作用,生物可降解纳米材料由于具有优异的生物相容性、生物降解性和低毒性等特点,可保护抗原不被降解,提高抗原稳定性,提供缓释性,增强免疫原性,已被公认为是用作疫苗载体/佐剂的理想材料[1]。
纳米材料增效疫苗递送
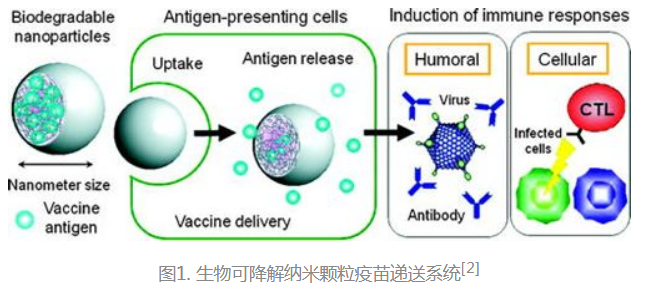
生物可降解纳米材料按其获取方法主要分为两类:天然生物可降解材料和合成生物可降解材料。
天然生物可降解材料主要是从植物和动物中提取的,因此毒性较小,具有生物相容性和生物可降解性,但机械强度低、延展性和水溶性较差,包括壳聚糖、透明质酸、脂质体、海藻酸钠等。
大多数合成生物可降解材料是通过分子缩合或聚合引入酯结构而形成的高分子量聚合物,其中较成熟的有壳聚糖衍生物、聚乳酸-羟基乙酸(PLGA)、聚酸酐、聚赖氨酸树枝状接枝物(DGL)、聚乳酸(PLA)等,这些材料具有良好的力学性能,易于通过化学或物理改性来控制[1]。
下面将就其中几种材料作为疫苗佐剂和载体的研究进展作具体介绍☟
壳聚糖作为一种天然的生物高聚物,具有生物相容性、生物衍生性、生物可降解性、免疫刺激性、黏附性、无毒性、血液相容性、抗肿瘤性、抗氧化性、抗菌性等优点,价廉易得,因而广泛应用于生物医学工程研究中,已有许多研究表明壳聚糖纳米粒是非常有前途的疫苗载体:
- Zhao等以壳聚糖纳米粒包载新城疫苗,并通过粘膜接种于鸡体内,增强了免疫应答反应,延长了质粒DNA的释放[3]。
- Oliveira等制备了负载SmRho抗原的壳聚糖纳米粒,并在表面包覆海藻酸钠盐,使该纳米粒具有良好的稳定性、靶向性和免疫刺激性。经口服免疫后,该纳米颗粒可诱导小鼠体内细胞因子IL-10的表达水平上调,对曼氏血吸虫病感染起显著保护作用,使其成为一种潜在的可有效预防血吸虫病传播的疫苗[4]。
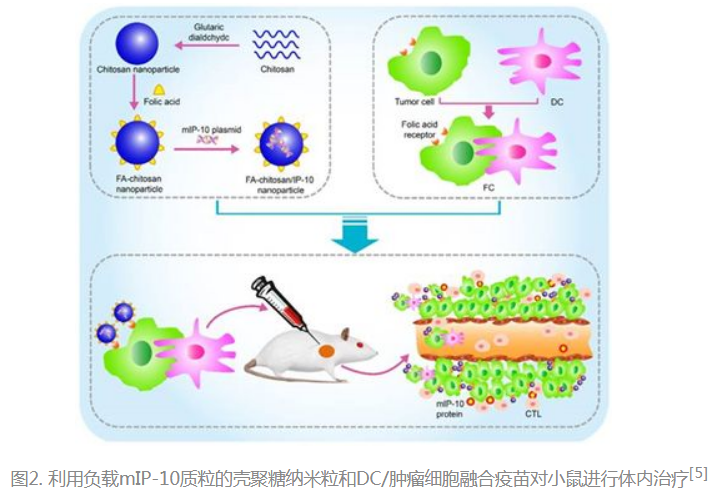
- 树突状细胞(DC)与肿瘤细胞融合疫苗被认为是一种有效的肿瘤生物学治疗方法,然而其在早期临床试验中的治疗效果并不理想,部分原因是肿瘤免疫抑制的环境,Hu等将叶酸修饰的负载mIP-10质粒的壳聚糖纳米粒子与表面携带叶酸受体的DC与肿瘤细胞融合疫苗相结合,形成FA -壳聚糖/mIP-10联合DC/肿瘤细胞融合疫苗,接种于小鼠后,可有效抑制肿瘤免疫抑制环境,增强DC/肿瘤细胞融合疫苗的抗肿瘤效果[5]。
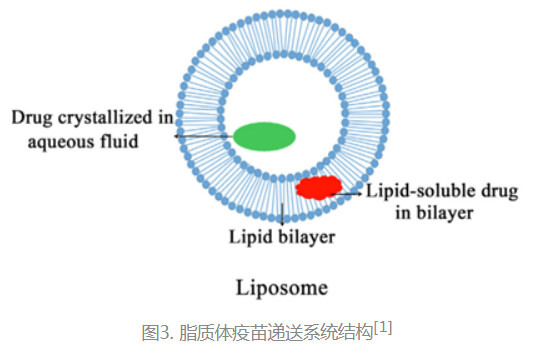
脂质体是由脂质双分子层组成的、内部为水相的闭合囊泡的结构,具有生物膜的功能和特性,其结构特征使脂质体能够有效包裹多种药物并控制药物的释放(点击本公众号文章《脂质体纳米载药技术》了解详情)。目前脂质体作为高效诱导体液及细胞免疫的佐剂被广泛用于感染性疾病及癌症疫苗中,成为最具潜力的疫苗递送系统之一。
- 2017年发表在Nature上的一篇文章指出采用脂质纳米颗粒包裹低剂量的寨卡病毒mRNA可在小鼠和非人类灵长类动物中产生有效和持久的中和性抗体反应,使其获得持续性的寨卡病毒免疫能力,为全球抗击寨卡病毒提供一种新的和有希望的候选疫苗[6]。
- 针对此次新冠肺炎疫情,同济大学附属东方医院转化医学平台与上海斯微生物科技有限公司合作,于2020年1月28日已紧急完成纳米疫苗的立项备案。研究人员将利用相关平台技术,快速合成针对本次新冠病毒关键靶点的多种不同抗原序列的信使RNA(mRNA),并通过纳米脂质(LPP)载药技术制备成制剂,通过体内、动物试验,筛选和验证有效抗原,称将在40天内完成大规模预防性新冠肺炎疫苗样品的生产和制备,增强了全民击退新冠肺炎的信心。
聚乳酸羟基乙酸共聚物(PLGA)是由乳酸(LA)和羟基乙酸(GA)两种单体随机聚合而成的可降解的功能性高分子有机化合物。具有良好的生物相容性、可降解性和药物缓释作用,已被广泛应用于纳米颗粒给药系统的开发中(点击本公众号文章《PLGA-b-PEG纳米载药平台系列介绍之一:PLGA-b-PEG共聚物的起源,合成及物化性能》《PLGA纳米载药平台系列介绍(2)— PLGA纳米递药系统及在癌症治疗中的应用》了解详情)。
- Zhao等以PLGA纳米颗粒负载猪流感DNA疫苗,结果表明,PLGA纳米颗粒可实现质粒DNA的长期释放[7]。随后他们又采用PLGA纳米颗粒包载新城疫病毒F基因DNA疫苗,使疫苗具有较强的体液、细胞和粘膜免疫应答,并实现了抗原的缓释[8]。然而, PLGA纳米颗粒表面通常带负电荷,对表面抗原的吸附和细胞的吸收有一定的限制,需要对PLGA纳米颗粒疫苗递送系统进行合理设计以解决这一问题。
- Gu等发现将当归多糖(ASP)和卵清蛋白(OVA)包裹在PLGA纳米颗粒(ASP-PLGA/OVA)中作为疫苗传递系统,可诱导有效的体液和细胞免疫应答,为进一步探讨PLGA纳米颗粒表面电荷和抗原负载方式对长期疫苗接种效果的影响,分别制备了三种不同的PLGA纳米颗粒:带负电荷的PLGA纳米颗粒(ASP-PLGA/OVA)、带正电荷的PEI包被PLGA纳米颗粒(ASP-PLGA/OVA-PEI)和带正电荷的PEI和OVA抗原包被PLGA纳米颗粒(ASP-PLGA-PEIOVA),研究结果显示与带负电的PLGA纳米颗粒相比,另外两种表面带正电荷的PEI包被PLGA纳米颗粒均能促进抗原从胞内体逃逸,从而诱导机体产生免疫应答;与表面吸附OVA抗原的PLGA纳米颗粒相比,将OVA抗原包裹在PLGA纳米颗粒里面的两组均能诱导更为有效和长期的抗原抗体特异性反应,综上表明PEI包被和内部负载抗原的PLGA纳米颗粒(ASPPLGA/OVA-PEI)作为一种疫苗佐剂传递系统具有诱导强烈和长期体液和细胞免疫应答的潜力[9]。
本期主要对生物可降解聚合物纳米材料作为疫苗载体或佐剂在开发更安全、更有效疫苗的应用潜力作简要介绍,愿此类疫苗递送系统能为新冠肺炎疫情控制提供一批有希望的候选疫苗,早日击退疫情。
NanoEast愿基于可降解纳米载体技术平台,与广大科研工作者以及工业界疫苗开发者共同攻克纳米疫苗载体关键核心技术,赋能中国医疗行业与健康事业发展!
参考文献
[1] Yan, X.,Zhou, M., Yu, S., Jin, Z., & Zhao, K. (2020). An overview of biodegradablenanomaterials and applications in vaccines. Vaccine, 38(5), 1096.
[2] Akagi, T.,Baba, M., & Akashi, M. (2011). Biodegradable nanoparticles as vaccineadjuvants and delivery systems: regulation of immune responses bynanoparticle-based vaccine. In Polymers in nanomedicine (pp. 31-64).Springer, Berlin, Heidelberg.
[3] Zhao, K., Zhang, Y., Zhang, X., Li, W., Shi,C., Guo, C., ... & Cui, H. (2014). Preparation and efficacy of Newcastledisease virus DNA vaccine encapsulated in chitosan nanoparticles. International Journal of nanomedicine, 9, 389.
[4] Oliveira, C. R., Rezende, C. M., Silva, M. R.,Pêgo, A. P., Borges, O., & Goes, A. M. (2012). A new strategy based onSmRho protein loaded chitosan nanoparticles as a candidate oral vaccine againstschistosomiasis. PLoS neglectedtropical diseases, 6(11),e1894.
[5] Hu, Z., Chen, J., Zhou, S., Yang, N., Duan, S.,Zhang, Z., ... & Zhao, Y. (2017). Mouse IP-10 gene delivered byfolate-modified chitosan nanoparticles and dendritic/tumor cells fusion vaccineeffectively inhibit the growth of hepatocellular carcinoma in mice. Theranostics, 7(7), 1942.
[6] Pardi, N., Hogan, M. J., Pelc, R. S.,Muramatsu, H., Andersen, H., DeMaso, C. R., ... & Wagner, W. (2017). Zikavirus protection by a single low-dose nucleoside-modified mRNAvaccination. Nature, 543(7644), 248.
[7] Zhao, K., Shi, X., Zhao, Y., Wei, H., Sun, Q.,Huang, T., ... & Wang, Y. (2011). Preparation and immunologicaleffectiveness of a swine influenza DNA vaccine encapsulated in chitosannanoparticles. Vaccine, 29(47), 8549.
[8] Zhao, K., Li, W., Huang, T., Luo, X., Chen, G.,Zhang, Y., ... & Cui, H. (2013). Preparation and efficacy of newcastledisease virus DNA vaccine encapsulated in PLGA nanoparticles. PLoS One, 8(12), e82648.
[9] Gu, P.,Wusiman, A., Zhang, Y., Liu, Z., Bo, R., Hu, Y., ... & Wang, D. (2019).Rational design of PLGA nanoparticle vaccine delivery systems to improve immuneresponses. Molecular Pharmaceutics, 16, 5000.