哪些热点备受国自然青睐?
点击阅读原文
2019年国自然已经落下帷幕,但是其中的“门道”值得我们去反复解读,相信大家对2019国自然医学部的热门方向的分析解读文章已经看了很多,对2020年的国自然申请的风向标也有所了解。
今天我们就另辟蹊径,就纳米技术与生物医学交叉(尤其是与肿瘤学交叉)并促进医学研究创新进行分析,希望能够为广大医学研究者提供创新研究思路,通过医工结合推动纳米技术在医学诊疗中的应用转化。
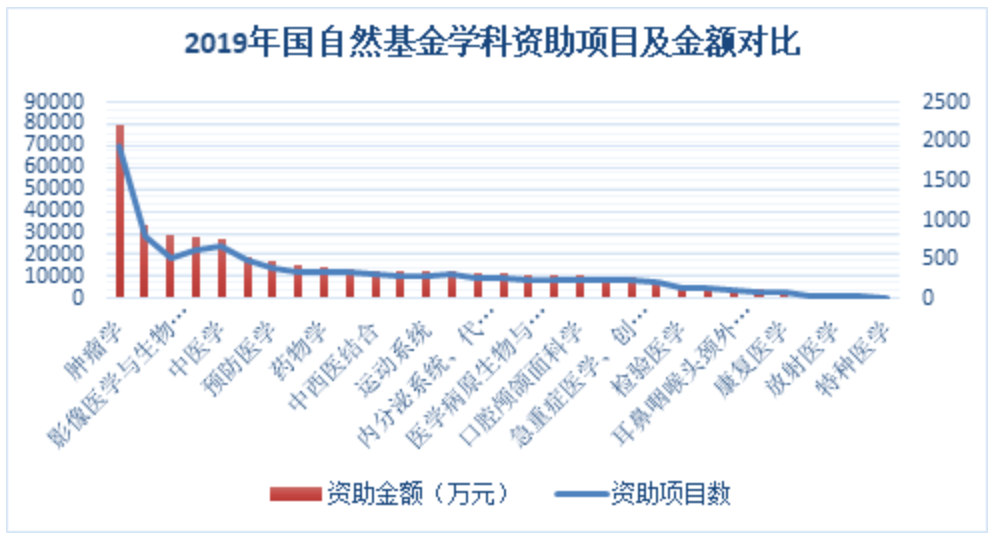
数据来源:MedSci [http://www.medsci.cn/article/show_article.do?id=eca41e74898e]
就2019年国自然基金资助医学研究的项目及金额对比来看,肿瘤学远远领先,其中肿瘤微环境长期以来都是肿瘤研究当中一个关键和核心的方向,对于认识肿瘤的发生、发展、转移等过程有着重要的意义,而且对于肿瘤的诊断、防治和预后亦有着重要的作用。
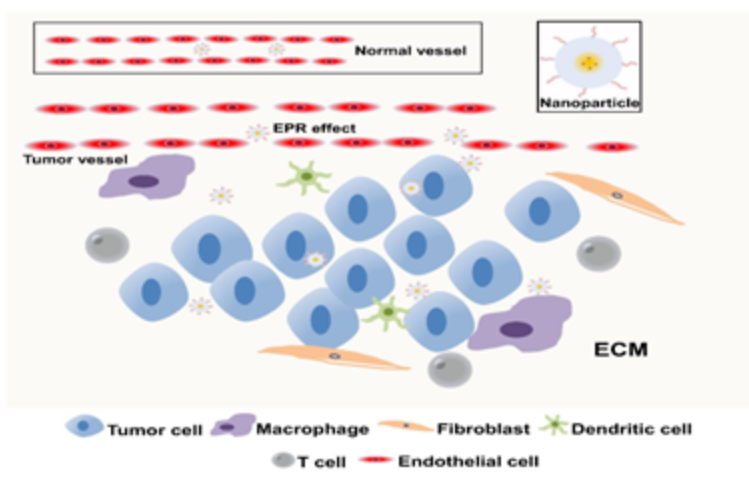
Fig.1. EPR效应在TME中积累NPs的示意图[Life Sci. 2018, 201: 37–44]肿瘤微环境(Tumor microenvironment,TME),即肿瘤细胞产生和生活的内环境,其中不仅包括了肿瘤细胞本身,还有与肿瘤细胞有密切联系的成纤维细胞、免疫和炎性细胞、胶质细胞等各种细胞,同时也包括附近区域内的细胞间质、微血管以及浸润在其中的生物分子。
现在主流趋势是借助纳米材料来研究肿瘤微环境,这种趋势是建立在固体瘤具有ERP效应(enhanced permeability andretention effect)的理论基础上发展起来的,即实体瘤具有高通透性和滞留效应,相对于正常组织来说,某些尺寸的分子或者颗粒更趋向于聚集在肿瘤组织(如图1所示)。
NanoEast小编系统梳理了相关文献,目前纳米材料主要从以下四个方面对肿瘤微环境进行调节或者抑制,从而达到肿瘤治疗的目的。
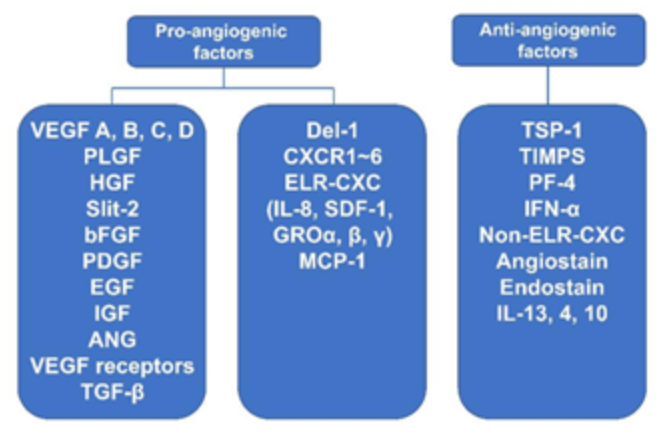
Fig.2.与血管生成相关的促血管生成因子和抗血管生成因子[Cancer letters. 2006, 236:157-163]血管生成是一个新血管形成的过程,被认为是实体肿瘤进展、增殖和转移的先决条件。血管生成是一个复杂的过程,受到许多促血管生成因子以及多种抗血管生成因子的严格控制和调控。支持肿瘤生长的促血管生成因子含有一系列促血管生成细胞因子,因此可以通过抑制血管生成从而进行早期肿瘤的治疗或预防。近年来有大量文献来描述新型的纳米颗粒(NPs)抑制肿瘤血管生成,其中负载化学药物的NPs、负载治疗基因的NPs、pH响应型NPs是应用最广泛的。
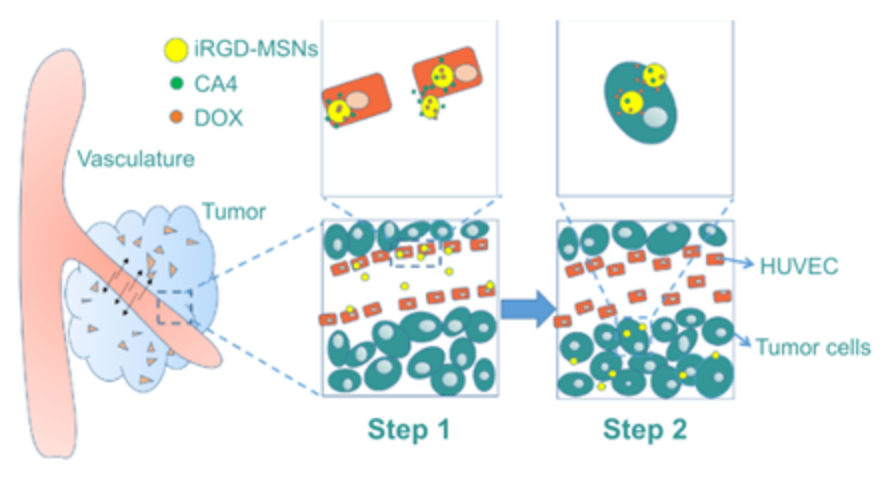
Fig.3. 抗血管生成剂(CA4)和阿霉素(DOX)在肿瘤中的传递示意图[Int J Nanomedicine. 2015, 11: 93-105]上述纳米材料就是典型的负载抗血管生成剂以及化疗药物的双递送NPs。以介孔二氧化硅纳米颗粒为载体,共载抗血管生成剂(CA4)和化疗药物(DOX),并与靶向分子(iRGD肽)结合,用于联合抗血管生成和化疗。抗血管生成剂在肿瘤血管中的快速释放导致血管结构的破坏,对随后向肿瘤输送化疗药物以及药物的缓慢释放产生协同作用。
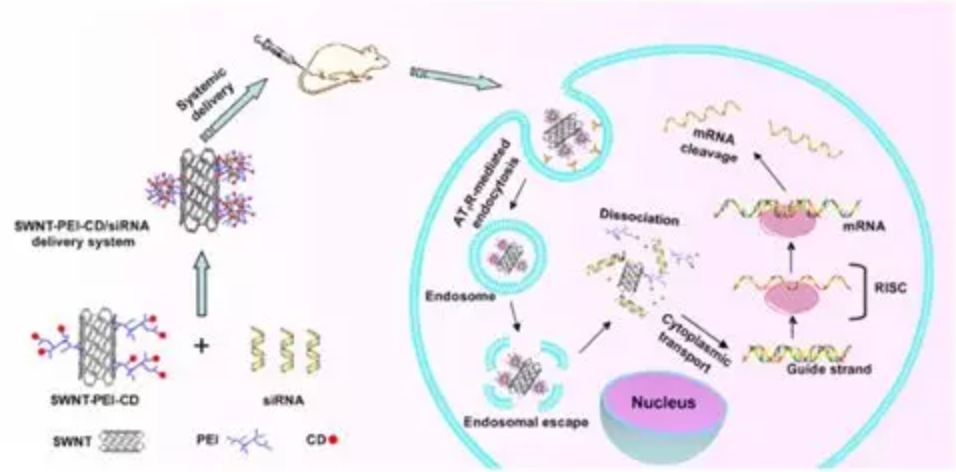
Fig 4.负载CD / siRNA共递送系统组装过程和细胞内运输途径示意图[ACS Appl Mater Interfaces.2017, 9(28): 23353-23369]负载基因的NPs应用的原理则是RNA干扰,是调节预期基因表达和干扰肿瘤细胞信号转导的有效途径。以单壁碳纳米管作为载体,表面修饰聚乙烯亚胺(PEI),并进一步负载CD(一种化疗药物)和siRNA。静脉内给药后,共递送系统中的药物和siRNA沉默相关的VEGF下调产生协同抗血管生成作用,从而改善体内肿瘤治疗。
02 细胞外基质(ECM)重塑
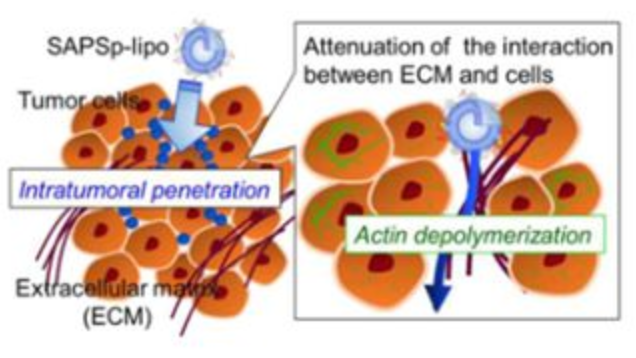
Fig 5.微酸性pH敏感肽修饰脂质体(SAPS p-Lipo)瘤内穿透示意图[Biomacromolecules. 2017, 18(2): 535-543]固体瘤外层包裹着致密的细胞外基质,ECM是由胶原蛋白、弹性蛋白、糖蛋白和蛋白多糖等大分子组成的复杂网络,因此给治疗药物到达肿瘤核心带来了困难。有学者设计了一种阳离子和中性脂质组成的SAPSP纳米颗粒,对微酸性pH(约6.5)具有较高的敏感性,并且总电荷从负向正转变,从而提高肿瘤细胞的纳米颗粒摄取率,伴有肌动蛋白解聚,减弱了癌细胞与ECM之间的相互作用。同时也发现这种纳米复合体可降低胶原整合素βi的表达水平,从而削弱肿瘤细胞与ECM之间的异质性粘附。
03 通过肿瘤相关成纤维细胞(TAFs)进行调节TEMTAFs是间充质样细胞,在肿瘤发生和肿瘤转移中起着关键作用。各种研究表明,TAFs可直接导致纳米药物的肿瘤穿透性差和高水平的耐药性。
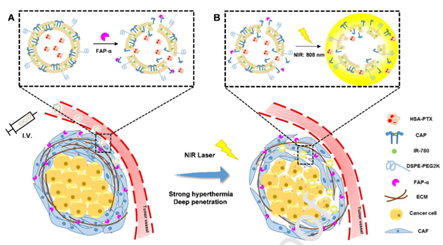
Fig 6. 负载光热剂IR-780 的热敏脂质体发挥作用示意图[J Control Release. 2020, 321: 564-575]胰腺癌富含癌症相关的成纤维细胞(TAFs),它们参与肿瘤基质的形成。然而,胰腺癌的致密肿瘤基质为药物递送提供了阻碍,从而成为了胰腺癌治疗的障碍,这也是胰腺癌被称为“万癌之王”的主要原因。有学者设计了结合光热剂IR-780的热敏脂质体,这种纳米颗粒能够靶向TAFs的膜生物标记FAP-α,并且能够吸收转化近红外(NIR)激光能量。在近红外激光的辐照下,IR-780产生高热,同时杀死肿瘤细胞并扩大肿瘤间隙,便于药物进入瘤体。
04 通过肿瘤相关巨噬细胞(TAMs)进行调节TEM
TAMs是一类广泛存在于TME中的免疫细胞。在血管生成的早期,TAMs可以通过分泌多种细胞因子来识别和清除肿瘤细胞。但随着肿瘤的发展,TAMs则会促进肿瘤细胞的增殖、侵袭和转移。众所周知,巨噬细胞可以常规地分为两种极化表型:M1和M2。其中M1巨噬细胞可以释放多种促炎因子,免疫激活因子和趋化因子,以通过免疫激活和吞噬作用抑制肿瘤。而M2巨噬细胞被认为与TME有密切的相互作用,M2巨噬细胞分泌的VEGF,PDGF,IL-17则会促进肿瘤血管的形成。
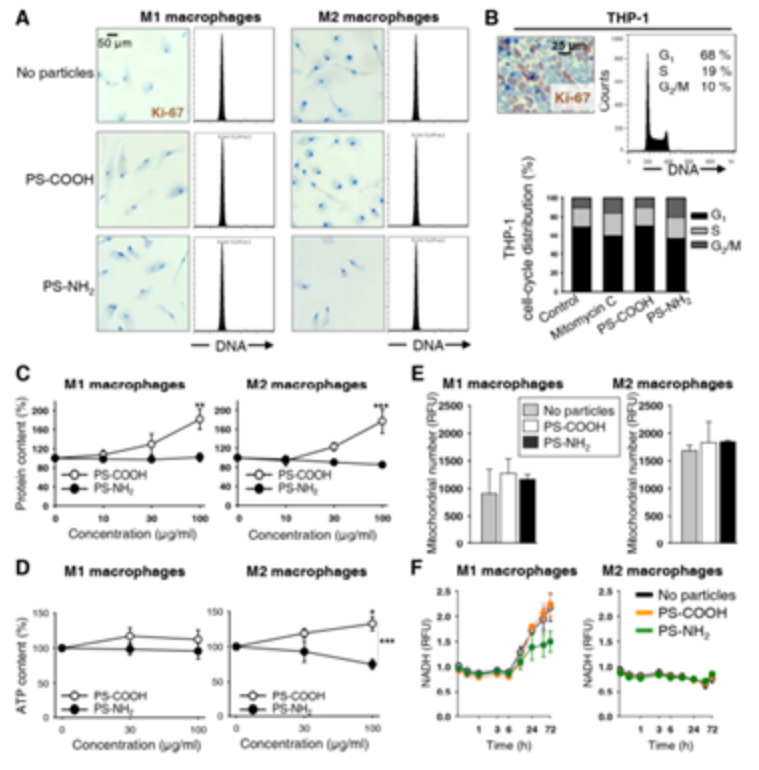
Fig 7.暴露在氨基和羧基功能化聚苯乙烯纳米颗粒中的M1和M2巨噬细胞的增殖、蛋白质含量和线粒体功能[Biomaterials. 2016, 85: 78-87]有学者发现羧基和氨基功能化聚苯乙烯纳米颗粒对M1和M2巨噬细胞亚群的极化分布有不同的影响,纳米颗粒使M2巨噬细胞极化倾斜而不会影响M1标记。考虑到M1和M2极化对于癌症或慢性炎症患者的免疫平衡至关重要,因此功能化的纳米颗粒可能会成为重新编程M1 / M2极化的工具。
综上所述,多功能纳米颗粒旨在以不同方式调节TME,包括抗血管生成,细胞外基质(ECM)重塑,肿瘤相关成纤维细胞(TAFs)治疗和肿瘤相关巨噬细胞(TAMs)治疗。捕捉和利用TME的特征进行NPs设计可有助于逆转肿瘤耐药性,优化药物释放,最终实现更有效的癌症治疗。