
点击阅读原文
新型细胞外囊泡是由细胞释放的各种具有膜结构的囊泡的统称,根据其起源细胞不同而具有大小和组成异质性,主要分为外泌体(Exosomes)、微囊泡(Microvesicles)、凋亡小体(Apoptotic body)和肿瘤小泡(Large oncosomes)。
外泌体(点击往期文章《东纳生物推出外泌体检测、鉴定与多功能标记服务 ——TEM、NTA、WB与标记》了解外泌体分离与鉴定方法)起源于内吞途径,由细胞内的多泡小体(MVB)与细胞膜融合并释放到细胞外,直径约30-150 nm;微囊泡由质膜向外发芽和裂变而产生,直接从细胞膜释放,直径约100-1000 nm;凋亡小体是在细胞程序性死亡过程中形成的,直径约为50 nm-2 μm;肿瘤小泡是在肿瘤细胞中发现的一种尺寸在1-10 μm的细胞外囊泡[1]。
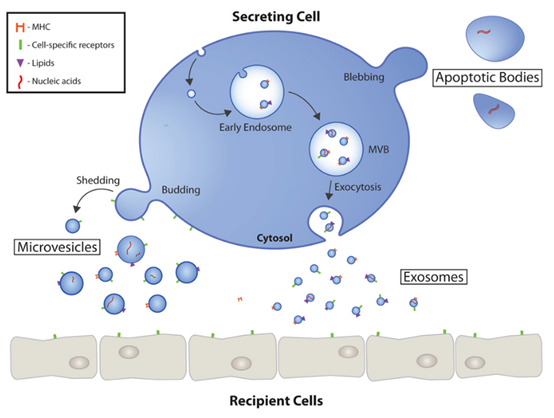
图1 细胞外囊泡的形成与释放过程[1]
细胞外囊泡携带着从母细胞获得的脂质、糖蛋白、核酸等成分,在磷脂双分子层的保护下,其内容物在血液中稳定存在,另一方面脂质层的存在也使细胞外囊泡能够穿透体内的天然屏障(如血脑屏障)将携带的内容物递送至受体细胞,参与细胞间的信号传导。文献报道细胞外囊泡除了转运内源性物质外,还可以将外源性核酸、化学药物等传递到受体细胞,从而达到干预或者治疗的目的。其中凋亡小体和肿瘤小泡的物理化学特性使得它们不适合作为药物递送载体,而外泌体因免疫原性低、稳定性好、传递效率高、能跨越血脑屏障等特点更加适合作为药物纳米递送载体[2]。目前文献中提供了不同的方法来实现细胞外囊泡载药,这些方法可以大致分为两大类:间接载药和直接载药[3]。
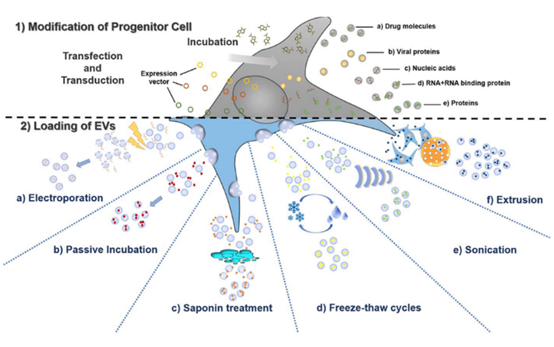
图2 通过细胞外囊泡母细胞间接载药和细胞外囊泡直接载药两种方式实现细胞外囊泡载药[3]
间接载药是通过处理细胞外囊泡母细胞来实现细胞外囊泡载药的,载药效率较低,主要分为两种:
1)直接孵育:将待负载药物与母细胞直接孵育,使分泌出的细胞外囊泡中天然含有此药物,适用于对细胞毒性较小的小分子化学药物。Wang等采用紫杉醇和阿霉素与人肿瘤细胞(人乳腺癌细胞MCF7、卵巢癌细胞A2780等)共孵育,并从培养基上清中获取外泌体,以评估化疗药物对外泌体产生、释放的影响及外泌体在细胞间药物传递的作用[4];
2)转染或转导:待负载药物通过转染的方式进入母细胞中,进而使其分泌的细胞外囊泡中也带有此种药物,主要适用于核酸、病毒蛋白等。Arda采用mRNA/蛋白转染母细胞,释放出高表达mRNA/蛋白的细胞外囊泡,诱导癌细胞凋亡[5]。
直接载药是另一种更为常见的策略,将待载药物直接装入细胞外囊泡中,载药效率更高,主要分为以下几种:
1)直接孵育:将待负载药物与细胞外囊泡直接孵育,适用于小分子化学药物,例如将外泌体与疏水性药物姜黄素在22℃下孵育5 min,姜黄素可自组装至外泌体的脂质双分子层中。以外泌体作为姜黄素的递送载体,可增加姜黄素的溶解度、稳定性和生物利用度,增强姜黄素向活化的单核细胞传递,并增强其抗炎活性[6]。天津大学研究人员采用表面偶联转铁蛋白的超顺磁性Fe3O4纳米颗粒(文章中使用的羧基化四氧化三铁纳米颗粒采购自本公司,点击往期文章《东纳生物产品助力肿瘤杀手—磁性靶向性外泌体》了解详情)捕获血液中带转铁蛋白受体的外泌体,并将磁性外泌体与阿霉素共孵育获得“磁化”并载药的外泌体,不仅解决了外泌体难提取的问题,也使外泌体兼具磁靶向性和抗肿瘤药物特性[7]。2)电穿孔:将高强度电场作用于细胞外囊泡,使其膜上形成瞬态空隙,促进待负载药物透过脂质膜进入细胞外囊泡,适用于核酸、化学药物等。Faruqu等通过电穿孔将siRNA包载至HEK-293细胞分泌的外泌体中,并在体外递送至人胰腺癌(PANC-1)癌细胞[8]。
其他载药策略还有室温孵育、皂素透化、冻融循环、超声和挤压等。Fuhrmann等人利用皂素的渗透作用将卟啉负载至外泌体,使光毒性卟啉在体外的细胞摄取和治疗效果显著提高[9]。不同方法的载药效率不同,需要研究人员根据情况选择合适的方法。
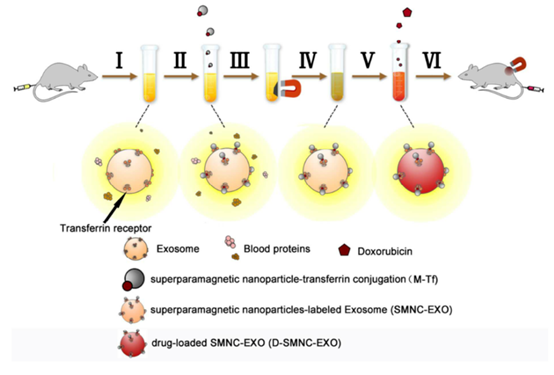
图3 “磁化”并载抗肿瘤药物阿霉素的外泌体递药系统[7]
本期主要对细胞外囊泡形成过程、常见载药策略及应用做简要介绍,在后续的更新中,我们将对细胞外囊泡靶向给药及如何增强其靶向性做进一步讨论和介绍,敬请关注。
参考文献
[1] Gustafson,D., Veitch, S., & Fish, J. E. (2017). Extracellular Vesicles asProtagonists of Diabetic Cardiovascular Pathology. Frontiersin cardiovascular medicine, 4, 71.
[2] Tian, T., Zhang, H. X., He, C. P., Fan, S., Zhu, Y. L., Qi,C., ... & Gao, J. (2018). Surface functionalized exosomes as targeted drugdelivery vehicles for cerebral ischemia therapy. Biomaterials, 150,137-149.
[3] Rufino-Ramos, D., Albuquerque, P. R., Carmona, V., Perfeito,R., Nobre, R. J., & de Almeida, L. P. (2017). Extracellular vesicles: novelpromising delivery systems for therapy of brain diseases. Journal ofControlled Release, 262, 247-258.
[4] Wang, J., Yeung, B. Z., Cui, M., Peer, C. J., Lu, Z., Figg,W. D., ... & Au, J. L. S. (2017). Exosome is a mechanism of intercellulardrug transfer: application of quantitative pharmacology. Journal ofControlled Release, 268, 147-158.
[5] Mizrak, A., Bolukbasi, M. F., Ozdener, G. B., Brenner, G. J.,Madlener, S., Erkan, E. P., ... & Saydam, O. (2013). Genetically engineeredmicrovesicles carrying suicide mRNA/protein inhibit schwannoma tumorgrowth. Molecular Therapy, 21(1), 101-108.
[6] Sun, D., Zhuang, X., Xiang, X., Liu, Y., Zhang, S., Liu, C.,... & Zhang, H. G. (2010). A novel nanoparticle drug delivery system: theanti-inflammatory activity of curcumin is enhanced when encapsulated inexosomes. Molecular Therapy, 18(9), 1606-1614.
[7] Qi, H.,Liu, C., Long, L., Ren, Y., Zhang, S., Chang, X., ... & Hou, X. (2016).Blood exosomes endowed with magnetic and targeting properties for cancertherapy. ACS nano, 10(3), 3323-3333.
[8] Faruqu,F. N., Xu, L., & Al-Jamal, K. T. (2018). Preparation of exosomes for siRNAdelivery to cancer cells. JoVE (Journal of Visualized Experiments),(142), e58814.
[9] Fuhrmann,G., Serio, A., Mazo, M., Nair, R., & Stevens, M. M. (2015). Active loadinginto extracellular vesicles significantly improves the cellular uptake andphotodynamic effect of porphyrins. Journal of Controlled Release, 205,35-44.
- 助力科研创新,帮助客户成功!-
