众所周知,在大多数脑癌中,血脑屏障(BBB)的存在是药物输送的重要障碍[1]。BBB是内皮细胞,星形胶质细胞,周细胞,基底层和细胞外基质(ECM)之间的复杂相互作用。这些成分与平滑肌细胞和神经元一起形成神经血管单位(NVU),进而调节脑血流量和BBB功能。这种严格调节的屏障的结果是毒素和药物(包括化学疗法)不易穿过血脑屏障,给药物向大脑的输送带来了麻烦。
总结发现,当前用于克服血脑屏障的药物递送方法主要有以下5种:
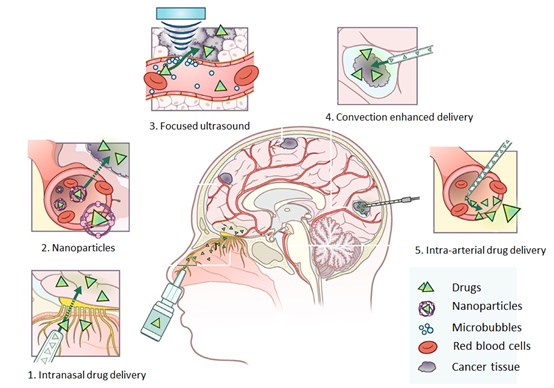
图1 当前用于治疗原发性脑肿瘤的药物递送方法的概述[2]
第1组:鼻内药物输送
药物以喷雾颗粒形式进行配制,这些喷雾颗粒通过神经上皮通过鼻腔进入大脑。在这里,药物可以不受血脑屏障(BBB)干扰地进入。药物通过从鼻腔神经上皮细胞到CNS的细胞旁,跨细胞和神经元运输而传递到大脑。
然而,并不是所有的药物都适合鼻内给药,因为特定的物理化学性质和配方决定了药物在大脑中的生物利用度。一般来说,低分子量的亲脂性药物(例如脂质体、环糊精等)经鼻给药后比带电荷的亲水药物表现出更好的生物利用度[3]。另外,药物通过鼻腔输送的优点是药物不会被首过代谢所代谢。但是,缺点是可通过鼻内进行给药的体积很小。
第2组:纳米颗粒
纳米颗粒包裹药物以延长血浆半衰期,并通过增强的通透性和保留(EPR)效应,内吞作用和受体介导的胞吞作用进入脑实质。纳米颗粒渗出后,包封的药物可以缓慢释放到组织中。由于纳米粒子无法在大多数器官中穿过正常的脉管系统,因此降低了外周和全身毒性。
纳米颗粒能够穿过泄漏的血脑屏障,这可能是脑肿瘤药物递送的一种潜在方法。但实际上在临床试验中,纳米粒子无法在肿瘤中达到治疗浓度[4]。但是,表现出有益特性的纳米粒子,例如在长时间内持续释放药物,可能会与其他药物递送方法联合用于治疗脑肿瘤[5,6]。例如通过模拟选择素或细胞粘附分子对BBB内皮细胞和白细胞的相互作用,仿生纳米粒子可以实现跨BBB靶向药物的传递[7]。
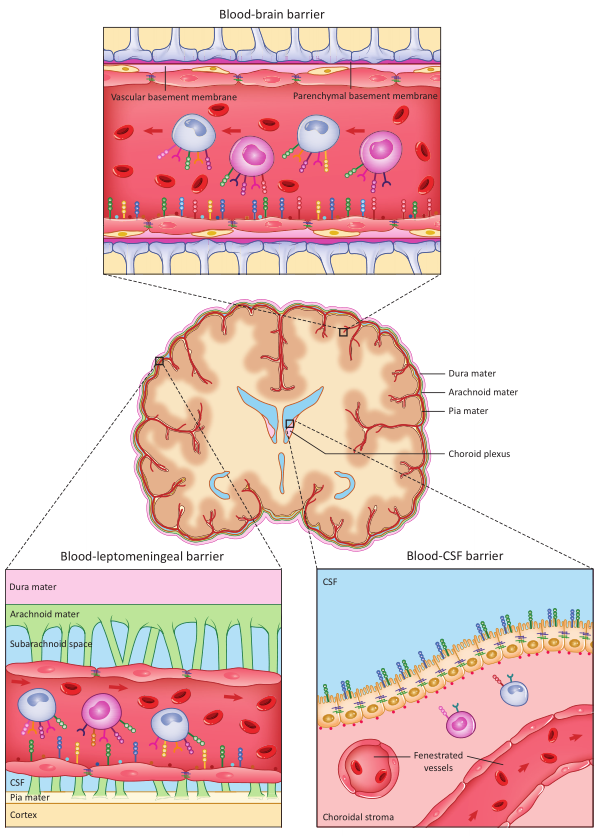
图2 跨脑屏障运输的免疫细胞的示意图[7]
第3组:微泡介导的聚焦超声
静脉内使用微泡,应用聚焦超声后,微泡开始振荡。振荡会破坏血脑屏障,暂时打开血脑屏障,使药物进入脑实质。微泡介导的聚焦超声(FUS)或声穿孔术是目前已知的将药物靶向性递送到脑肿瘤的一种最小/非侵入性方法[11]。
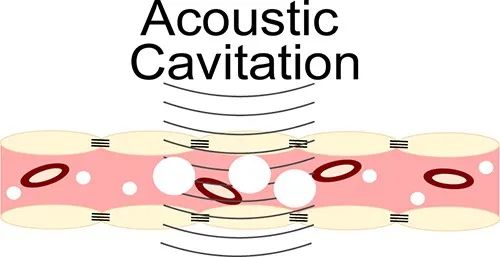
图3 声空化和血脑屏障破坏[11]
在超声开始时静脉内注射微泡(白色)。当血管内微泡进入超声场时,它们以超声频率膨胀和收缩。这导致与内皮细胞的相互作用以及最终的血脑屏障破坏。
第4组:对流增强传送(CED)
CED是在脑部进行外科手术以将导管直接置于肿瘤部位。该方法包括放置一个或多个连接到外部输液泵的颅内导管,这样允许通过建立的压力梯度将治疗剂直接输送到目标组织中,局部输注可确保脑实质中更高的治疗浓度,而全身毒性较小[8]。但是,这种技术也有一些缺点,因为注入的药物可以被排泄/吸收到脉管系统中,因此高度血管肿瘤可能不太适合[9]。
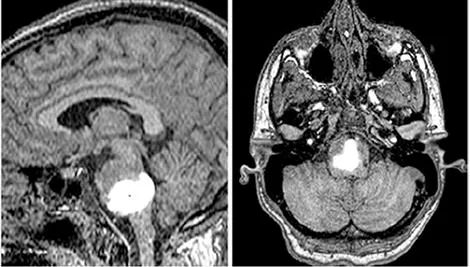
图4 弥漫性桥脑神经胶质瘤患者的白细胞介素13假单胞菌外毒素与替代成像示踪剂(Gd-DTPA)共注入的磁共振成像[10]
第5组:动脉内药物输送
在肿瘤附近进行血管导管化和直接注射药物,有时与高渗药物组合使用,打开BBB。动脉内给药是将药物直接注入肿瘤附近的动脉中,插入目标区域后,药物会释放到血管中。除药物外,还可以使用高渗药物(例如甘露醇)来局部打开血脑屏障。该技术已成功治疗视网膜母细胞瘤和肝癌[12]。
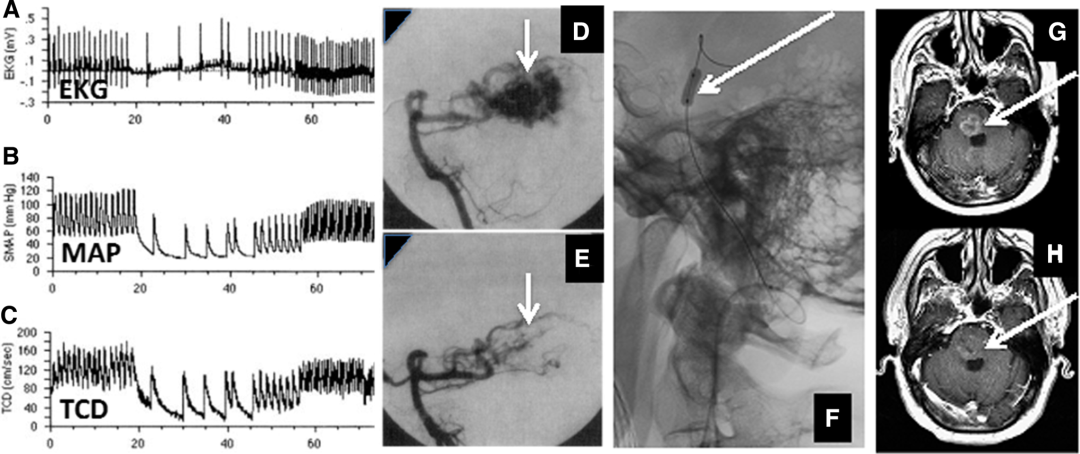
图5 动脉内药物输送法在临床中的实践(神经胶质瘤)
目前已经开发的几种药物递送方法,例如纳米颗粒递送,对流增强递送,聚焦超声,鼻内递送和动脉内递送以克服原发性脑肿瘤中的血脑屏障。结合诸如聚焦超声和纳米粒子等策略的药物递送可能是更成功的方法。但是,需要更多的研究来优化和开发新的药物递送技术,以改善原发性脑肿瘤患者的生存率。
[1] Allemani C, Matsuda T, Di Carlo V, Harewood R, Matz M,Nikšić M, et al. Global surveillance of trends in cancer survival 2000–14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries.Lancet.2018;391(10125):1023–75.[2] Haumann R, Videira JC, Kaspers GJL, van Vuurden DG, Hulleman E. Overview of Current Drug Delivery Methods Across the Blood-Brain Barrier for the Treatment of Primary Brain Tumors.CNS Drugs.2020 Sep 23.[3] League-Pascual JC, Lester-McCully CM, Shandilya S, Ronner L, Rodgers L, Cruz R, et al. Plasma and cerebrospinal fluid pharmacokinetics of select chemotherapeutic agents following intranasal delivery in a non-human primate model. J Neurooncol.2017;132(3):401–7.[4] Arvanitis CD, Ferraro GB, Jain RK. The blood–brain barrier and blood–tumour barrier in brain tumours and metastases. Nat Rev Cancer. 2019;2:1–16.[5] Etame AB, Diaz RJ, Oreilly MA, Smith CA, Mainprize TG,Hynynen K, et al. Enhanced delivery of gold nanoparticles with therapeutic potential into the brain using MRI-guided focused ultrasound. Nanomedicine. 2012;8(7):1133–42.[6] Sawyer AJ, Saucier-Sawyer JK, Booth CJ, Liu J, Patel T, Pie-pmeier JM, et al. Convection-enhanced delivery of camptothecin-loaded polymer nanoparticles for treatment of intracranial tumors. Drug Deliv Transl Res. 2011;1(1):34–42.[7] Charabati M, Rabanel JM, Ramassamy C, Prat A. Overcoming the Brain Barriers: From Immune Cells to Nanoparticles. Trends Pharmacol Sci. 2020 Jan;41(1):42-54. [8] Bobo RH, Laske DW, Akbasak A, Morrison PF, Dedrick RL,Oldfield EH. Convection-enhanced delivery of macromol-ecules in the brain. Proc Natl Acad Sci. 1994;91(6):2076–80.[9] Mehta A, Sonabend A, Bruce J. Convection-enhanced delivery. Neurotherapeutics. 2017;14(2):358–71.[10] Lonser RR, Sarntinoranont M, Morrison PF, Oldfield EH. Convection-enhanced delivery to the central nervous system. J Neu-rosurg. 2015;122(3):697–706.[11] Burgess A, Hynynen K. Noninvasive and targeted drug delivery to the brain using focused ultrasound. ACS Chem Neurosci.2013;4(4):519–26.[12] Joshi S, Ellis JA, Ornstein E, Bruce JN. Intraarterial drug delivery for glioblastoma mutiforme. J Neurooncol.2015;124(3):333–43.