研究背景及内容
肺癌是癌症相关死亡的主要原因之一,其中非小细胞肺癌约占85%。针对特定突变间变性淋巴瘤激酶(ALK)的分子靶向抑制剂艾乐替尼(alectinib)可以将ALK阳性的非小细胞肺癌患者的中位无进展生存期有效延长至34.8个月。但44.0%接受艾乐替尼治疗的患者均发生了严重的不良反应。最近Zeng F.J.等人[1]开发了磁性/TAT双靶向递送艾乐替尼的纳米载体。磁靶向有效地增强了载艾乐替尼的纳米颗粒从血管到肿瘤组织的外渗,TAT靶向显著提高了肿瘤细胞对纳米载体的摄取。结果表明,这种双靶点聚合物纳米载体具有良好的治疗效果,并在体内诱导肿瘤收缩。同时,这种双靶向纳米载体也将艾乐替尼引起的肝毒性降至最低,为扩大艾乐替尼的应用提供了一种有效的策略。
结果展示
该研究设计了修饰TAT靶向肽,以2,3-二甲基马来酸酐(DA)修饰的二嵌段共聚物DATAT-PEG-b-PHEP将疏水磁性Fe3O4纳米颗粒及艾乐替尼进行包载形成级联靶向纳米载体。这种纳米载体能降低免疫系统对纳米颗粒的清除,增加纳米载体的外渗。TAT具有肿瘤靶向作用,Fe3O4介导的磁靶向(magnetic guidance, MG)可有效增强纳米粒子从血管到肿瘤组织的外渗作用。
将TAT-PEG-b-PHEP、艾乐替尼加入到超纯水中,室温下超声1 h,转入14000 Da透析袋中透析48 h,过0.45 μm滤膜,得到TAT-NCA。
DATAT-PEG-b-PHEP、艾乐替尼、Fe3O4(10 nm,南京东纳生物科技有限公司)加入到超纯水中,室温下超声1 h,转入14000 Da透析袋中透析48 h,过0.45 μm滤膜,得到DATAT-MNCA。
所合成的TAT-NCA平均直径约为122.0 nm,呈规则的球形形貌,对艾乐替尼的包封率为44.9%,在与含10%胎牛血清的PBS共孵育24 h后,大小略有增大,说明其胶体稳定性较好。且TAT-NCA释放的艾乐替尼呈pH依赖性,在pH 7.4、pH 6.5和pH 5.5时,TAT-NCA分别释放量约为36.0%、43.8%和51.3%,表明艾乐替尼在肿瘤细胞中可以加速释放。
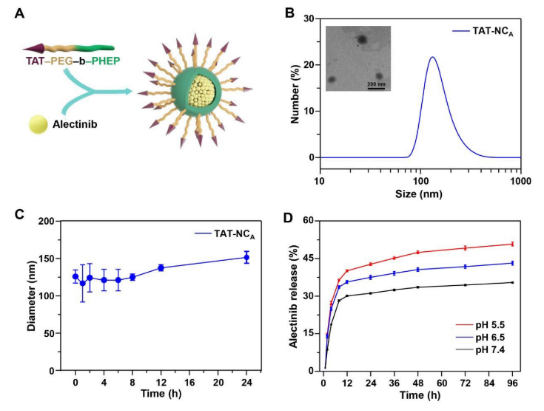
图1. A: TAT-NCA制备示意图; B: TAT-NCA的尺寸分布和TEM图像; C: TAT-NCA在10%FBS中的尺寸变化; D: TAT-NCA在不同pH溶液中艾乐替尼的释放曲线。
TAT的修饰显著增强了肿瘤细胞对TAT-NCA的摄取(图2A)。使用无TAT修饰的纳米颗粒NCA作为对照(两者均用DiD标记),与H2228细胞共培养4h,如图2B所示,不含TAT的NCA孵育后,只有H2228细胞胞内荧光信号较弱,TAT-NCA组细胞内红色荧光信号明显改善,证明TAT的修饰显著提高了肿瘤细胞对载体的摄取。使用流式细胞术进一步测定,TAT-NCA孵育的细胞具有更强的荧光信号(图2C和2D),进一步证实了上述结论。
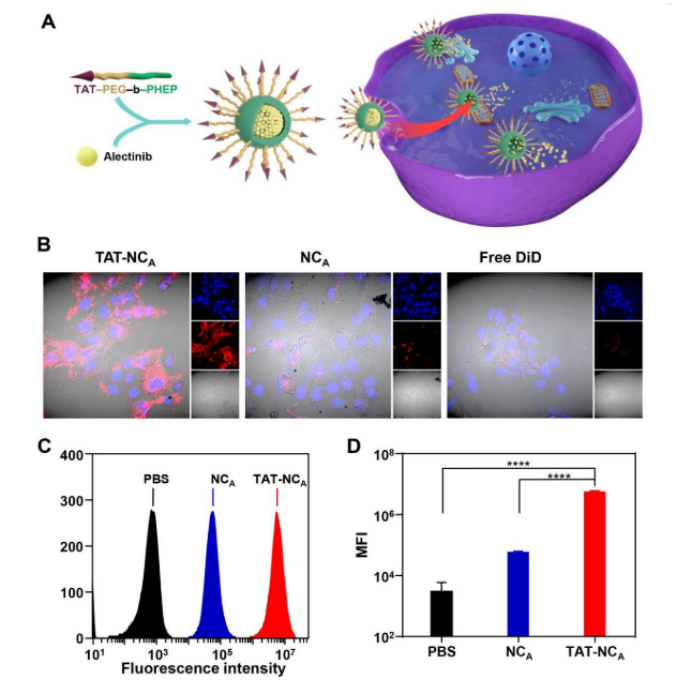
图2. A: TAT肽介导的H2228细胞对载艾乐替尼的纳米颗粒TAT-NCA的增强摄取示意图; B: TAT-NCA和不含TAT的对照制剂NCA孵育H2228细胞的CLSM图像(蓝色: DAPI信号;红色: DiD信号); C、D: TAT-NCA和NCA孵育4 h后H2228细胞的流式细胞直方图(C)和平均荧光强度(MFI)(D)
为了证明H2228细胞对TAT-NCA的摄取可提高治疗效果,该研究评估了TAT-NCA和游离艾乐替尼对H2228细胞的抗癌活性。图3A显示,TAT-NCA和游离艾乐替尼治疗均表现出剂量依赖的抗癌活性,且在所有浓度下TAT-NCA的细胞活力都远低于游离艾乐替尼。如图3B和3C所示,以1.25 μg/mL的艾乐替尼TAT-NCA处理72 h后,游离艾乐替尼诱导了50.7%的细胞凋亡(早期和晚期凋亡细胞),而TAT-NCA纳米颗粒使细胞凋亡率提高到80.08%。这些结果共同表明,TAT-NCA通过增强带有TAT修饰的NCA的细胞摄取,有效地提高了对ALK阳性NSCLC细胞的治疗效果。
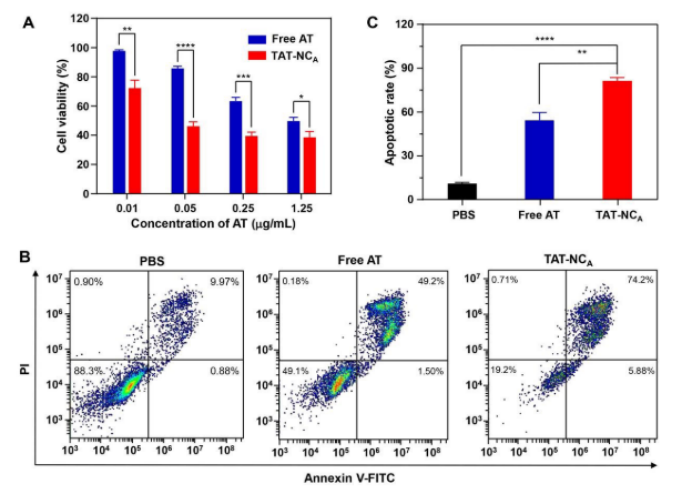
图3. A: 不同浓度游离艾乐替尼或TAT-NCA孵育H2228细胞后的细胞活力; B、C: 1.25 μg/mL游离艾乐替尼和TAT-NCA对H2228细胞凋亡的诱导效果。
为了降低免疫系统对纳米颗粒的清除,增加纳米载体的外渗,该研究使用了2,3-二甲基马来酸酐(DA)修饰的二嵌段共聚物DATAT-PEG-b-PHEP和疏水磁性Fe3O4纳米颗粒共包被到纳米载体中,所合成的艾乐替尼/Fe3O4共载纳米载体记为DATAT-MNCA。其中,Fe3O4介导的磁靶向(magnetic guidance, MG)可有效增强纳米粒子从血管到肿瘤组织的外渗作用,而重新激活肿瘤组织中的TAT靶向,提高肿瘤细胞对纳米载体的摄取,实现磁靶向与TAT靶向的级联效应(图4A)。紫外-可见光谱和透射电镜测量证实了包封成功(图4B)。艾乐替尼和Fe3O4的包封率分别约为40.7%和25.6%。为了证明双靶向效应,作者研究了DiD标记的DATAT-MNCA在H2228肿瘤小鼠体内的生物分布。将小磁铁附着于肿瘤部位,放置24小时,实现磁靶向。分别使用有MG和无MG作用的DATAT-MNCA注射,24 h内肿瘤部位的荧光强度逐渐升高(图4C)。注射后6 h,MG作用下的DiD荧光强度明显高于裸DATAT-MNCA组。注射后72 h,采集小鼠主要器官和肿瘤组织进行成像。如图4D和4E所示,DATAT-MNCA+MG组肿瘤组织的荧光信号明显强于裸DATAT-MNCA组。
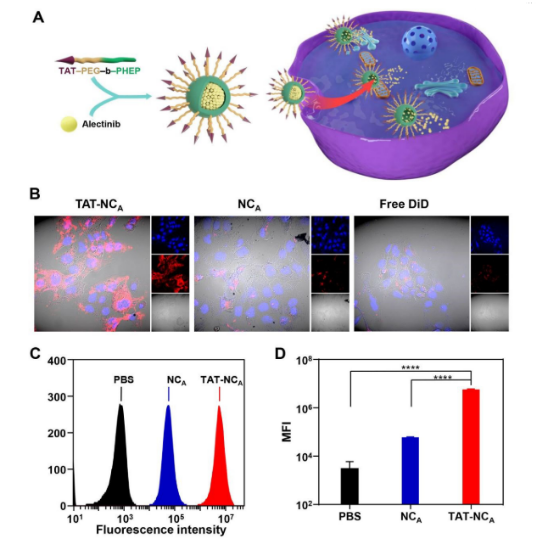
图4. A: DATAT-MNCA通过磁和TAT的级联靶向效应增强肿瘤聚集的示意图; B: 游离Fe3O4、游离艾乐替尼和DATAT-MNCA纳米粒子的紫外可见吸收光谱。插入的图片为DATAT-MNCA的TEM图像; C: 在H2228肿瘤小鼠中,加MG和不加MG的DiD标记的DATAT-MNCA荧光成像; D: 注射DiD标记的加MG和不加MG的DATAT-MNCA后72小时,在各主要器官和肿瘤中的离体图像; E: 图4D中肿瘤组织荧光信号定量。
此外,该研究还评估了DATAT-MNCA的级联双靶向效应的体内抗癌活性。对H2228肿瘤小鼠分别给予加MG和不加MG的DATAT-MNCA,以游离艾乐替尼作为对照。如图5A所示,与PBS组相比,游离艾乐替尼对H2228肿瘤的生长有轻微抑制作用。裸DATAT-MNCA治疗可有效抑制肿瘤生长,DATAT-MNCA联合MG治疗后,肿瘤缩小,治疗结束时肿瘤生长率下降至70.15%(图5B)。肿瘤组织的图像(图5C)和重量(图5D)进一步支持DATAT-MNCA+MG的最佳抗癌效果,免疫组织化学染色(图5E)也清楚地表明,DATAT-MNCA+MG组肿瘤细胞凋亡(绿色)水平最高,肿瘤细胞增殖(Ki67阳性,棕色)比例最低,进一步验证了上述结论。
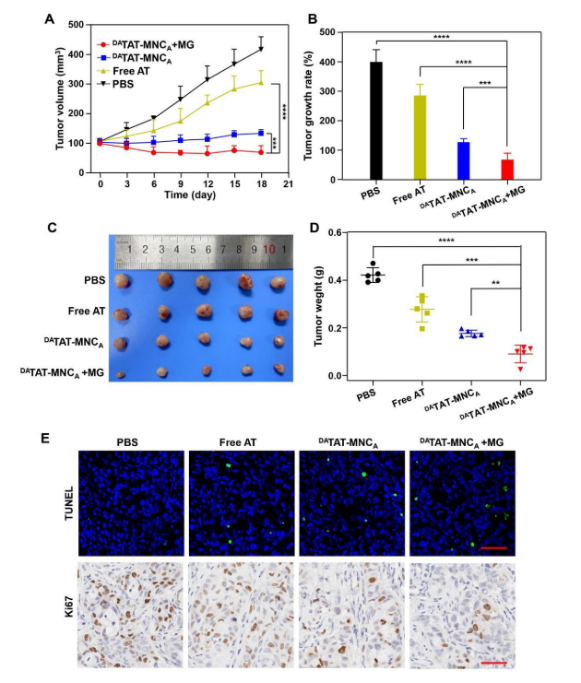
图5. A: H2228肿瘤生长曲线; B: 各组肿瘤抑制率; C、D: H2228肿瘤治疗结束时的图像(C)和权重(D); E: 不同治疗后肿瘤切片TUNEL和Ki67染色(标尺= 50 μm)。
为了评价该制剂的潜在不良反应,该研究还测定了其体内安全性(如图5所示)。对小鼠进行不同剂量的DATAT-MNCA和游离艾乐替尼的注射,并监测其体重的变化。结果显示当游离艾乐替尼的注射剂量为3.0或5.0 mg/kg时,小鼠体重明显下降;当注射剂量增加到10.0 mg/kg时,小鼠立即死亡。相比之下,在DATAT-MNCA治疗时,即使在10.0 mg/kg的注射剂量下,也没有观察到小鼠发生明显的体重下降,而且在任何注射剂量下都没有小鼠死亡。
除了体重外,该研究还分析了一些血清指标来评估DATAT-MNCA的安全性。在临床实践中,艾乐替尼引起的肝毒性是主要问题之一。结果表明,三种剂量游离艾乐替尼均会诱导碱性磷酸酶(ALP)、谷丙转氨酶(ALT)、天冬氨酸转氨酶(AST)和结合胆红素(DBIL)明显升高,且呈剂量依赖趋势。另外,三种注射剂量游离艾乐替尼的注射会引起尿素(UREA),肌酐(CREA)和尿酸(UA)的中度升高。与此形成鲜明对比的是,DATAT-MNCA治疗对这些肾功能和肝功能指标均无影响,即使在最高剂量10.0 mg/kg下,也显示了良好的安全性。
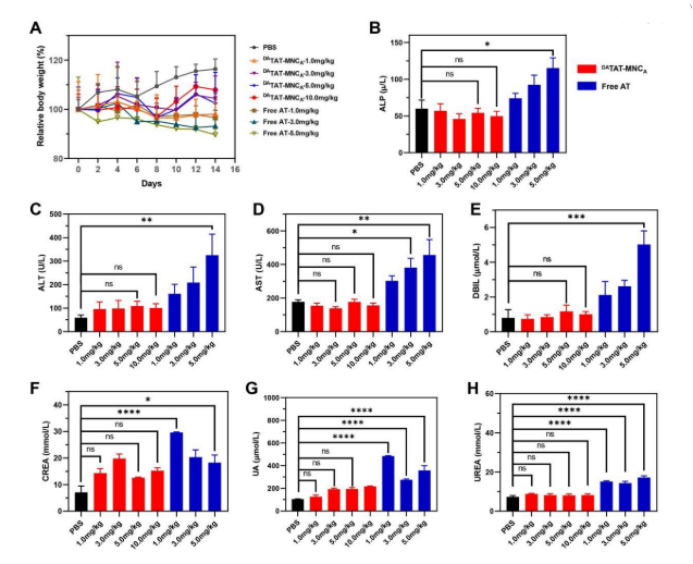
图6. A: 不同剂量DATAT-MNCA和游离艾乐替尼治疗后小鼠体重变化; B-H: 肝肾功能指数分析包括ALP (B)、ALT (C)、AST (D)、DBIL (E)、CREA (F)、UA (G)、尿素(H)。
进一步该研究采用H&E染色法对小鼠肝脏切片进行分析,如图7所示,游离艾乐替尼组在所有注射剂量下均出现局灶性坏死等炎症反应,而DATAT-MNCA纳米颗粒组即使在10.0 mg/kg的注射剂量下,与PBS组相比也没有明显的病理症状,进一步证实了DATAT-MNCA的安全性。
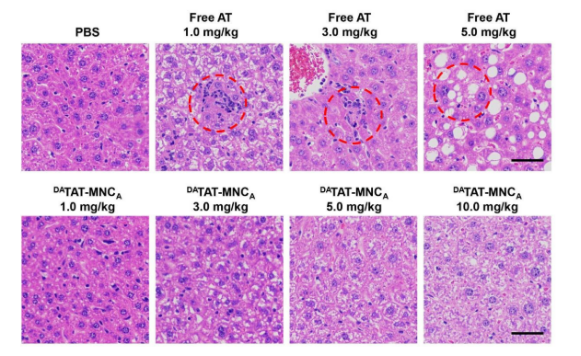
图7. 各组小鼠肝脏H&E分析(标尺= 50 μm)。
总结展望
综上所述,该研究成功探索了具有级联磁性和TAT靶向能力的负载艾乐替尼的纳米载体DATAT-MNCA。该纳米载体在表现出优越的治疗效果的同时,也能最小化艾乐替尼在小鼠模型中引起的肝毒性效应。这项研究为改善ALK阳性NSCLC治疗结果和减少艾乐替尼引起的不良反应提供了新的途径。
更多研究内容请关注网站http://www.nanoeast.net/新闻。东纳生物是生物医用磁性微纳米材料的专业制造商,将为您提供多种纳米产品,助力纳米科技转化应用研究。
相关文章
双载药空心普鲁士蓝靶向纳米体系及急性髓系白血病治疗
用于靶向捕获测序的链霉亲和素磁珠
新品推荐│羧基化葡聚糖磁性纳米颗粒
参考文献
[1] Zeng F, Xu B, Zhu H, et al. A cascade dual-targeted nanocarrier for enhanced alectinib delivery to ALK-positive lung cancer. Biomater Sci. 2020;8(22):6404-6413.
- 助力科研创新,帮助客户成功!-
