产品应用案例│磁性纳米颗粒和静磁场刺激骨间充质干细胞释放外泌体促进成骨和血管生成
创伤、肿瘤或感染引起的大骨缺损的治疗仍然是骨科医生面临的巨大挑战。目前临床骨修复的标准治疗方法是自体和异体骨移植,但受供体数量、供体部位并发症、疾病传播等因素的影响,应用受限;有许多研究希望利用骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)来促进骨再生,但耗时长、细胞需求量大、移植细胞存活率低、肿瘤形成风险大、存在免疫排斥等。
北京协和医学院的研究人员探究了低剂量Fe3O4纳米颗粒联合静磁场(static magnetic field ,SMF)预处理BMSCs释放的外泌体对成骨和血管生成的促进作用,为骨再生的治疗提供了新的见解。
研究人员选择50 μg/mL 100 nm Fe3O4纳米粒子(来自东纳生物)和100 mT SMF作为最佳磁条件制备两种新的外泌体,分别命名为BMSC-Fe3O4-Exos和BMSC-Fe3O4-SMF-Exos,未经Fe3O4和SMF处理的外泌体记为BMSC-Exo。
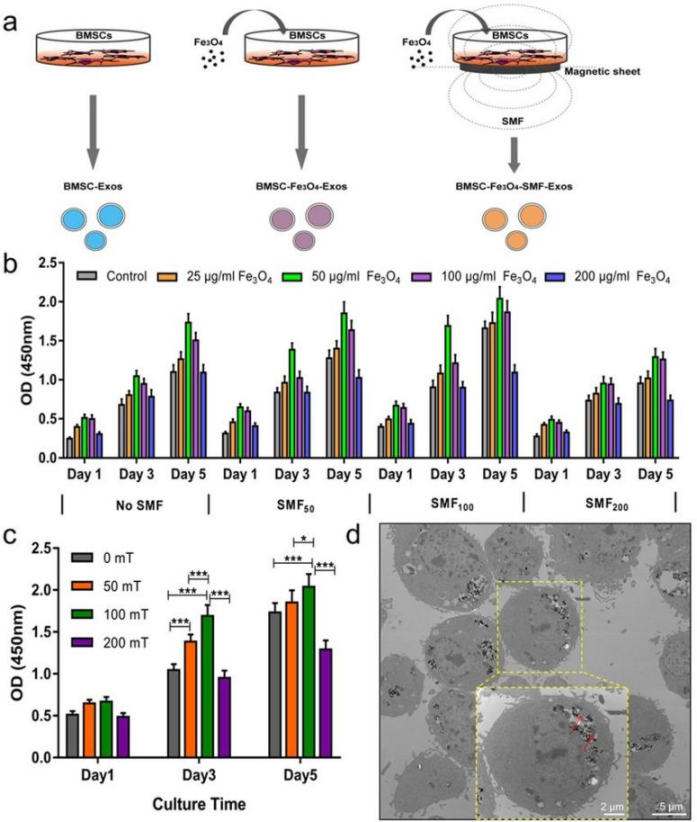
图1. 三种类型的外泌体制备、最佳磁条件筛选及内化了Fe3O4的BMSCs透射电镜
Fe3O4纳米颗粒和/或SMF预处理均可以增加BMSCs外泌体的释放量,且三种外泌体的形貌尺寸、特异性标志物无明显差别。荧光显微镜实时监测结果显示BMSCs和HUVECs(human umbilical vein endothelial cells,人脐静脉内皮细胞)更容易内化BMSCs经Fe3O4纳米颗粒和/或SMF预处理后释放的外泌体。
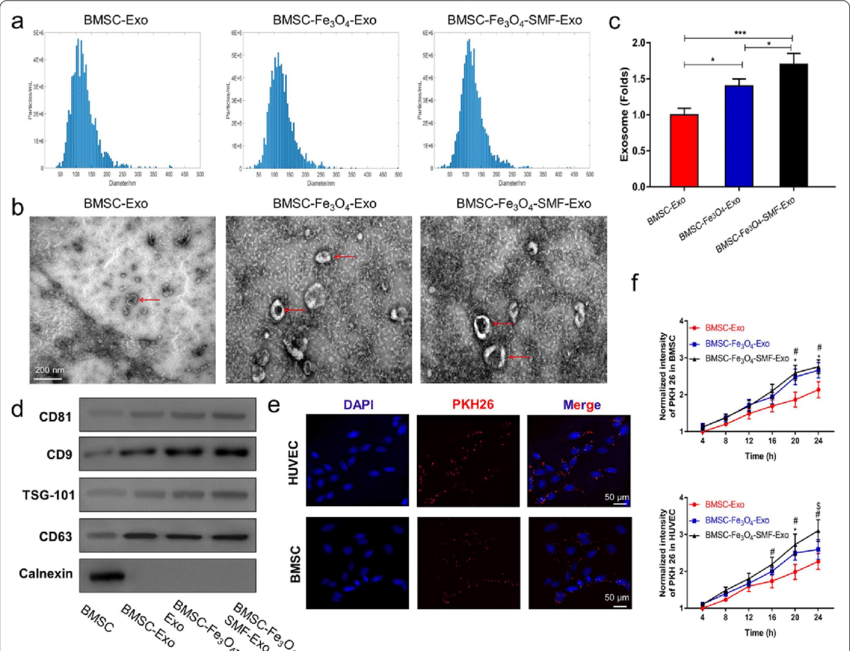
图2. 三种类型的外泌体的特征和细胞内化情况
体外实验结果显示,经Fe3O4纳米颗粒和SMF预处理后释放的外泌体组:钙积累量、ALP活性、成骨标志物基因及蛋白表达水平均明显增加;血管生成基因(VEGF、ANG-1和HIF-1α) 的mRNA及蛋白表达量显著上调;划痕实验和Transwell迁移/侵袭实验显示联合处理组产生的外泌体与HUVECs共培养后,HUVECs迁移速度明显快于其他两组外泌体,且在基质上产生更多的索状结构。综上,Fe3O4和静电磁场联合处理BMSCs细胞所释放的外泌体在体外对成骨和血管生成有明显的促进作用。
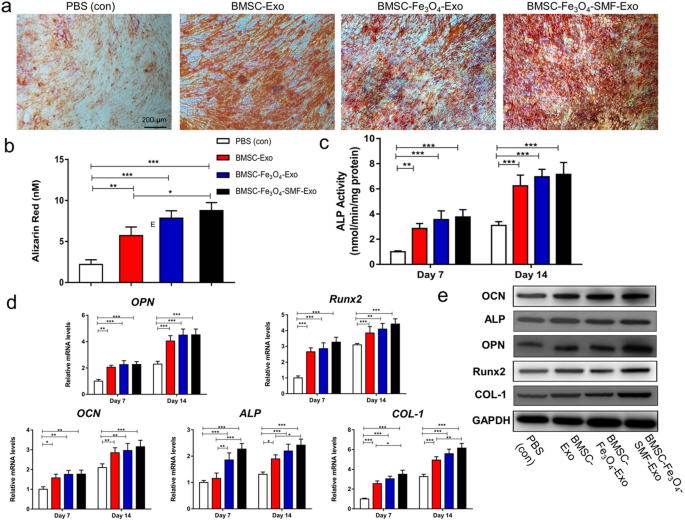
图3. 茜素红染色实验、ALP(BMSCs早期成骨分化标志物)活性检测及成骨标志物表达水平检测
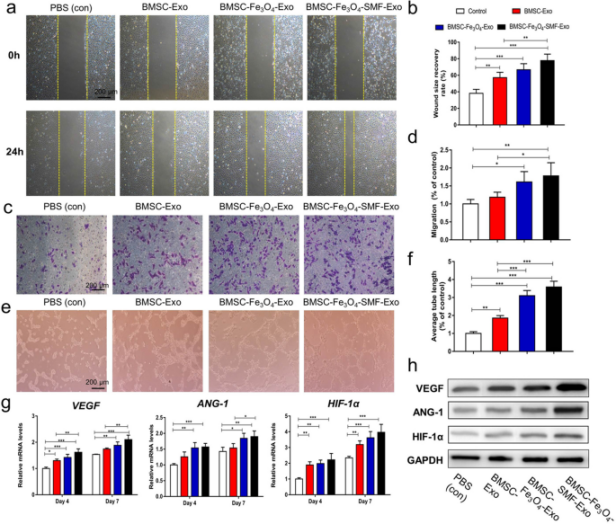
图4. 通过划痕实验、Transwell迁移/侵袭实验、血管生成基因及蛋白水平检测,确定外泌体对促血管生成活性的影响
随后研究人员通过micro-CT、免疫组化、免疫荧光等手段对经Fe3O4和/或静电磁场处理BMSCs产生的外泌体在体内对成骨破损及血管生成的影响进行了研究。结果显示Fe3O4和/或静电磁场处理BMSCs产生的外泌体均能促进体内颅骨缺损的骨再生及破损中心新生血管的形成,且联合处理组效果更为显著。
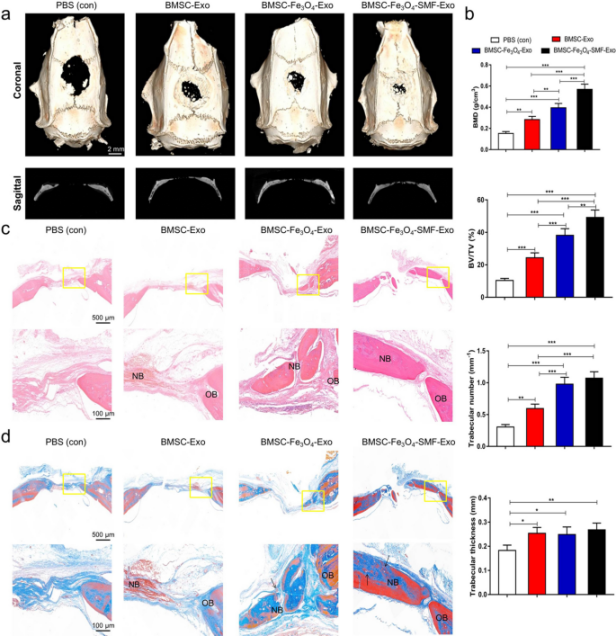
图5. Fe3O4和/或静电磁场处理BMSCs产生的外泌体对临界大小的大鼠颅骨缺损的骨形成的作用
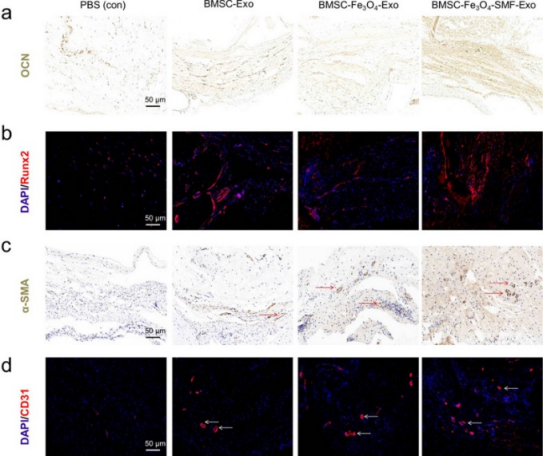
图6 Fe3O4和/或静电磁场处理BMSCs产生的外泌体对颅骨缺损的骨再生及新生血管形成的影响
本文作者通过一系列的体内外实验评估了经低剂量Fe3O4纳米颗粒和SMF预处理后的骨间充质干细胞所释放的外泌体对骨缺损愈合及新血管生成的促进作用,为未来骨再生治疗提供了新的视角。
参考文献
Wu D., Chang X., Tian J., Kang L., Wu Y., Liu J., Wu X., Huang Y., Gao B., Wang H., Qiu G., Wu Z., Bone mesenchymal stem cells stimulation by magnetic nanoparticles and a static magnetic field: release of exosomal miR-1260a improves osteogenesis and angiogenesis. J Nanobiotechnology. 2021,19: 209 (1-19).
“助力科研创新,帮助客户成功”
南京东纳生物科技有限公司
地址:南京市龙眠大道568 号,南京生命科技小镇5号楼,电话:025-83475811
网址:www.nanoeast.net