Nature Communication产品应用案例│东纳生物MagTransfTM磁转染试剂助力基因干扰铁死亡治疗癌症相关研究
氧化铁纳米颗粒已成功用于癌症诊断和治疗。许多研究表明,氧化铁纳米颗粒可以释放Fe2+或Fe3+到细胞的酸性溶酶体中,释放的Fe2+参与芬顿反应生成有毒羟基自由基(•OH),这是活性氧(ROS)之一,诱导癌细胞铁死亡。然而,细胞对铁浓度很敏感,浓度的轻微波动会引起很大的反应。细胞能够有效地储存并排出过量铁离子,因而可以削弱铁死亡的作用。
GIFT疗法构建
东南大学王进科教授研究组构建了基因干扰铁死亡治疗(Gene interfered-ferroptosis therapy,GIFT)方法,由基因干扰载体GIV(DMP的启动子和下游效应基因组成)和FeNP(氧化铁纳米颗粒,二巯基丁二酸包被,来自南京东纳生物科技有限公司)组成,通过DMP控制CRISPR/Cas13a和癌细胞中microRNA(miRNA),特异性敲除两个铁代谢基因FPN和LCN2的表达,从而抑制铁外排,使得进入肿瘤细胞的FeNP有效累计并发挥铁死亡作用,诱导各种血液肿瘤和实体瘤的细胞铁死亡,相关研究成果发表在Nature Communications(2021,12,5311,IF=14.919)。
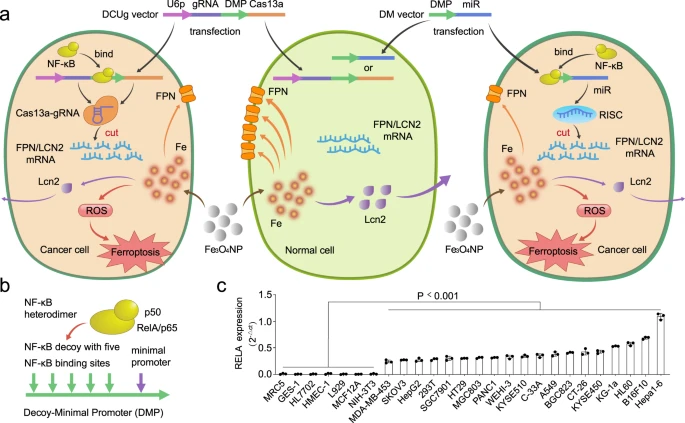
图1:基于CRISPR/Cas13a和miRNA的GIFT的示意图
NF-κB在几乎所有癌细胞中组成性激活,而在正常细胞中几乎没有活性;基于此生物学特征,文章设计了一种癌细胞特异性启动子DMP,该启动子由一段NF-κB诱骗子(Decoy)和一段最小启动子(Minimal Promoter)组成,可仅在NF-κB结合下启动下游效应基因的表达;文章进一步设计了可靶向敲低(knock down)两种铁外排基因FPN 和 LCN2的表达,导致氧化铁纳米颗粒FeNPs进入细胞后释放的铁离子不能被细胞主动外排,从而使得细胞内铁离子浓度升高,通过芬顿反应产生大量ROS(ROS中毒性最强的羟自由基),进而引发细胞膜脂质过氧化,从而导致细胞发生铁死亡。由于正常细胞中几乎没有NF-κB活性,载体进入后不能产生microRNA,不会导致FPN 和 LCN2的表达下降,细胞借此可有效排出铁纳米颗粒产生的铁离子,维持细胞的铁及氧化还原平衡。
GIFT体外抗肿瘤研究
为了研究GIFT的抗肿瘤作用,用各种质粒载体转染不同白血病和实体瘤的癌细胞,然后用FeNP处理。结果表明,两种GIV与FeNP的组合在所有肿瘤细胞中产生了显着的时间依赖性杀伤作用,单独的载体和FeNP及阴性对照质粒与FeNP的组合对细胞都无明显影响。
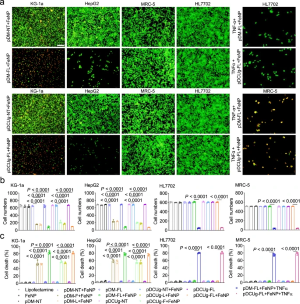
图2:GIFT治疗肿瘤和正常细胞
基于GIFT的铁死亡机制
据报道,铁基纳米材料可以通过芬顿效应上调ROS水平,为了研究在FeNP处理的细胞中是否产生ROS,测试各种处理下四个细胞中的ROS水平。结果显示,GIV与FeNP的组合导致所有癌细胞中ROS水平最高。进一步确认ROS来源,接下来测量处理细胞中的铁含量,结果显示,在FeNP和GIV的处理下,四种癌细胞的细胞内铁含量显着增加。在各种抑制剂存在的情况下用GIFT处理HepG2细胞,GIFT处理显着降低了细胞活力,接下来通过使用脂质氧化指示剂C11-BODIPY检测了脂质ROS(铁死亡的标志)。发现只有GIFT处理显着诱导HepG2细胞中的脂质ROS。
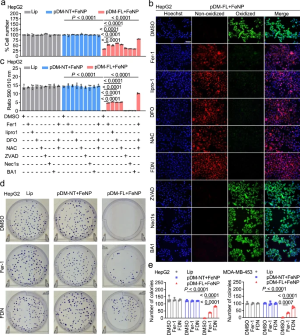
图3:GIFT诱导的铁死亡引起的细胞死亡
基于FeNC的GIFT抗肿瘤
为了验证氧化铁纳米颗粒是否可替代腺相关病毒载体进行基因递送,选择了PEI修饰的Fe3O4纳米颗粒(磁转染试剂MagTransfTM,用FeNC表示,来自南京东纳生物科技有限公司)作为DNA转染剂。第一个实验中,将质粒与FeNC结合以制备FeNC-1@DNA。KG-1a和HepG2细胞首先用FeNC-1@DNA处理仅用于转染GIV,然后用FeNP处理。结果表明,只有FeNC-1@pDM-FL/pDCUg-FL+FeNP导致显着的细胞死亡。在第二个实验中,为了简化GIFT试剂,去除了FeNP,只用FeNC@DNA处理了KG-1a细胞。结果表明,FeNC@pDM-FL的处理诱导了显着的细胞死亡,而单独的FeNC和pDM-FL并没有显着影响细胞生长。为了研究FeNC@DNA的稳定性,还用保存24小时的FeNC@pDM-FL处理了KG-1a细胞。结果表明,FeNC@DNA仍然具有相似的癌细胞杀伤作用。随后的脂质ROS和细胞活力检测也表明FeNC@pDM-FL通过铁死亡导致细胞死亡。

图4 FeNC转染各种质粒的KG-1a细胞
总 结
在肿瘤中全身递送的氧化铁纳米颗粒的浓度对于GIFT很重要。该研究表明,两种铁纳米颗粒(FeNP和FeNC)可以集中到肿瘤上,因此GIFT显著增加了肿瘤的铁含量。因为所使用的纳米颗粒没有被任何肿瘤特异性配体修饰,所以纳米颗粒能通过被动靶向(EPR效应)以及通过跨内皮途径的主动转运积累到肿瘤中。由于FeNP没有经过肿瘤特异性配体修饰,因此一般可用于治疗不同类型的肿瘤。目前,在肿瘤细胞表面,特别是在实体瘤上,很少发现高度特异性的生物标志物。因此,制备具有高度肿瘤特异性的纳米颗粒仍然很困难。另一方面,如果在纳米颗粒上修饰一种特定于一种肿瘤的靶向配体,这种纳米颗粒可能不适合治疗其他肿瘤,因为不同的肿瘤有不同的靶点,这会使用于治疗不同肿瘤的纳米粒子的制备复杂化。无论如何,用肿瘤特异性配体修饰的纳米颗粒可以通过积累更多的纳米颗粒来提高GIFT对肿瘤的治疗效果。氧化铁纳米粒子是唯一被批准用于临床的无机纳米颗粒,如作为磁共振造影剂和补铁制剂,因为它们被证明是安全的。本工作发展的GIFT方法通过肿瘤特异性基因敲低来增强细胞内铁累积,从而实现肿瘤特异性铁死亡治疗。
注:更多小鼠体内试验和药代动力学详见参考文献。
参考文献
J. L. Gao, T. Luo, J. K., Wang, Gene interfered-ferroptosis therapy for cancers., Nat. Commun., 2021, 12, 5311.
更多研究内容请关注网站http://www.nanoeast.net/新闻。Nanoeast是生物医用磁性微纳米材料的专业制造商,将为您提供多种纳米产品,助力纳米科技转化应用研究。
“助力科研创新,帮助客户成功”
南京东纳生物科技有限公司
地址:南京市龙眠大道568 号,南京生命科技小镇5号楼,电话:025-83475811
网址:www.nanoeast.net