在原发性肝癌中,肝细胞癌(HCC)占诊断病例的75-85%,唯一被FDA批准用于此类患者的药物-索拉非尼,也存在效率低、复发率高的影响。
氧化铁纳米颗粒(IONPs)可以作为自噬干预剂与自噬抑制剂如氯喹(CQ)、羟氯喹(HCQ)联合应用于治疗肝癌。然而,CQ和HCQ均可引起严重的视网膜病变,自噬抑制剂的毒性及其对杀瘤自噬的非选择性严重阻碍了联合治疗的应用。 为了解决这一问题,研究人员发现Fe2O3@DMSA (二巯基丁二酸修饰的三氧化二铁磁性纳米颗粒,南京东纳生物科技有限公司)单独作为一种自噬干预剂,可在不添加任何自噬抑制剂如CQ和HCQ的情况下,显著促进铁沉积诱导的持续ROS积累,直接干扰自噬过程,有效地抑制肝癌的生长(研究工作发表在Adv. Sci. 2020, 7, 1903323. IF 16.806)。 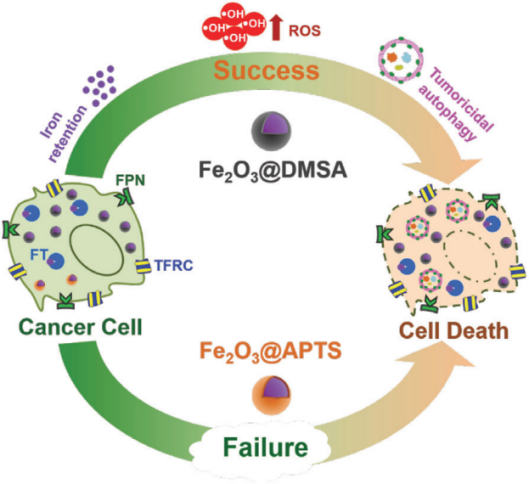
图1. 羧基功能化氧化铁纳米粒子(Fe2O3@DMSA)对铁运输系统产生重大影响,促进细胞内铁的保留,导致过度ROS诱导的肿瘤自噬
本文重点
1. 本研究工作中,研究人员使用大小和形态相似的Fe2O3@DMSA和Fe2O3@APTS(3-氨基丙基三乙氧基硅烷修饰的三氧化二铁磁性纳米颗粒,南京东纳生物科技有限公司),比较研究它们与肝癌细胞的相互作用。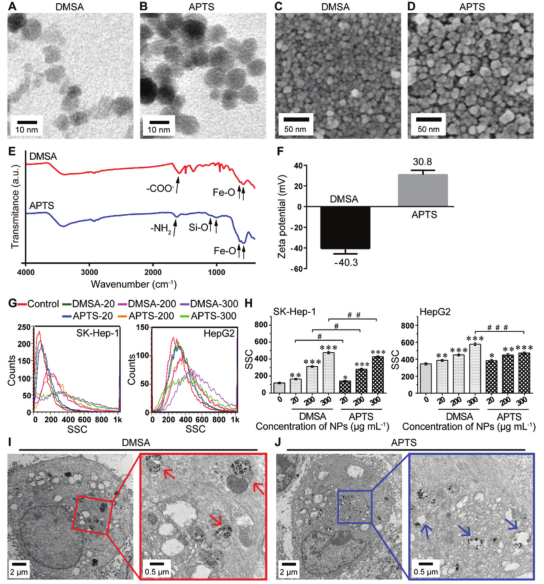
图2. Fe2O3@DMSA和Fe2O3@APTS
的表征和与肝癌细胞的相互作用研究
透射电镜(TEM)和扫描电镜(SEM)的表征结果显示Fe2O3@DMSA和Fe2O3@APTS具有相似的形状,大小约为10 nm。傅里叶红外光谱(FTIR)表征证实DMSA和APTS成功包覆在Fe2O3表面。Fe2O3@DMSA和Fe2O3@APTS的zeta电位分别约为-40.3±5.42和30.8±4.38 mV。流式细胞仪检测SK-Hep-1和HepG2细胞对Fe2O3@DMSA和Fe2O3@APTS的摄取情况,证实这两种IONPs是通过内吞作用被细胞内化的。 2. Fe2O3@DMSA单独对肝癌生长的有效抑制作用是通过抑制自噬体和溶酶体的融合来增强肿瘤自噬,而自噬是由细胞内铁滞留诱导的持续活性氧(ROS)产生引起的。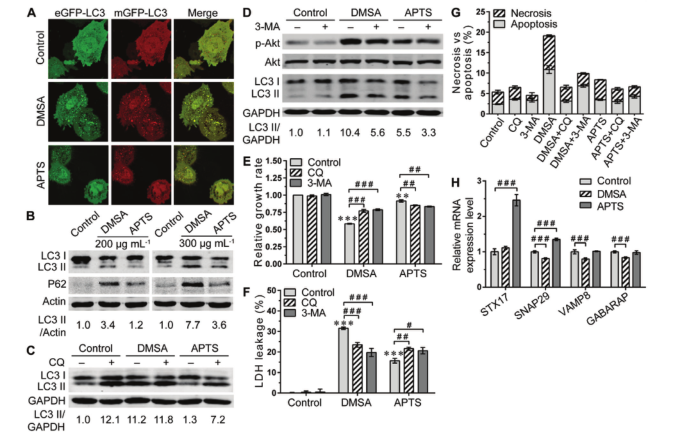
图3. Fe2O3@DMSA与Fe2O3@APTS
在SK-Hep-1细胞中诱导自噬和凋亡的能力对比
Fe2O3@DMSA诱导SK-Hep-1细胞的自噬激活和自噬小体积累,而Fe2O3@APTS加速了自噬过程。Fe2O3@DMSA和Fe2O3@APTS均明显提高了细胞凋亡与坏死的比例,但Fe2O3@DMSA处理的细胞的凋亡率和坏死水平更高。Fe2O3@DMSA通过诱导细胞自噬激活和损害自噬体-溶酶体融合,促进细胞凋亡和坏死;Fe2O3@APTS则通过加速自噬过程缓解细胞毒性。 3. 建立皮下异种移植裸鼠模型,进一步有效地验证了Fe2O3@DMSA的抗肿瘤自噬能力。在两例肝癌小鼠模型中,单独使用Fe2O32O3@DMSA可有效抑制肿瘤的生长,且无明显毒副作用。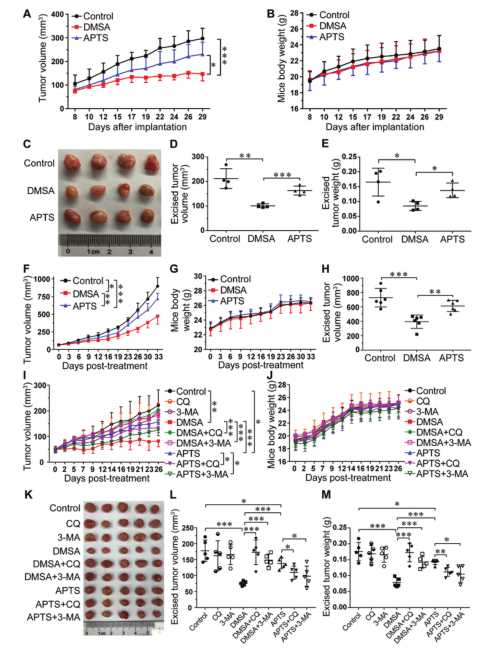
图4. Fe2O3@DMSA与Fe2O3@APTS
在肝癌小鼠模型中的治疗效果验证研究
Fe2O3@DMSA组和Fe2O3@APTS组在肿瘤生长曲线终点处肿瘤体积均显著降低。且Fe2O3@DMSA组肿瘤大小的下降明显大于Fe2O3@APTS组。与CQ或3-MA联合治疗会明显抑制Fe2O3@DMSA的抗肿瘤作用,而Fe2O3@APTS需要与自噬抑制剂联合使用才会获得更好的抗肿瘤效果,这充分证明Fe2O3@DMSA在不添加自噬抑制剂的情况下通过激活自噬通路,达到比Fe2O3@APTS更高的抗肿瘤效果。本文总结
通过以上实验,研究人员证明了Fe2O3@DMSA在不添加外源性自噬干预剂的情况下,诱导肿瘤细胞的自噬激活并削弱自噬通量,从而发挥抗肿瘤治疗作用。此外,Fe2O3@DMSA的抗肿瘤自噬不仅克服了自噬干预剂在体内分布的非选择性这一主要挑战,而且成功地避免了自噬化学干预剂的严重副作用。因此,该Fe2O3@DMSA抗肿瘤系统为我们提供了一种潜在的癌症治疗策略,并有利于IONPs在生物医学应用方面的发展。参考文献
[1] Y. X. Xie, J. N. Jiang, Q. Y. Tang et. al., Iron Oxide Nanoparticles as Autophagy Intervention Agents Suppress Hepatoma Growth by Enhancing Tumoricidal Autophagy, Adv. Sci., 2020, 7, 1903323.往期文章回顾