产品应用案例│LA−ICP−MS单细胞同位素稀释分析:单细胞中纳米颗粒定量的新方法
工程纳米颗粒(NPs)在得到广泛应用的同时,其潜在危害也引起了人们的日益关注。有必要从细胞水平上了解NPs的摄取、运输和相互作用,并且对单个细胞中的NPs进行定量研究。
激光烧蚀−电感耦合等离子体−质谱(LA−ICP−MS)是一种新兴的单细胞金属纳米颗粒分析方法。用激光烧蚀单个细胞,然后引入产生的气溶胶,高温离子源ICP能将样品中所有化学键都破坏,并有效电离所生成的元素同位素,进行分析。
然而,分析能力低和缺乏商业标准物质限制了其使用。本文作者开发了一种名为“单细胞同位素稀释分析”(SCIDA)的新方法,用于用LA−ICP−MS对单细胞中的NPs进行定量,具有可靠的定量能力、更高的灵敏度和更好的空间分辨率。此研究选择巨噬细胞(RAW 264.7)作为模型,在单细胞水平上研究银纳米颗粒(AgNPs,柠檬酸盐涂层,直径20nm,南京东纳生物科技有限公司)的摄取,工作发表在Analytical Chemistry(IF 6.986)。
本文重点
1.通过块细胞印刷技术(block-cell-printing)在培养皿上获得单细胞阵列,用商用喷墨打印机精确地分配了10 pL/cell已知质量的109Ag富集溶液。同时烧蚀单个细胞和打印液滴,并使用LA−ICP−MS进行同位素稀释分析。

图1.
SCIDA与LA−ICP−MS的示意图。(a)将聚二甲基硅氧烷(PDMS)模具放置在皮氏培养皿上组成微流控芯片,形成内部带有钩形陷阱的密封通道;(b)悬浮的单个细胞在流经通道时被陷阱捕获,RAW 264.7巨噬细胞的单细胞捕获效率可以达到∼100%;(c)捕获的单个细胞在与培养基孵育1小时后附着在培养皿上;(d)移除PDMS模具,阵列中∼90%的单个细胞能够保留在培养皿上并生长分裂,获得单细胞阵列;(e)使用喷墨打印机将一滴稀释的109Ag溶液分配到阵列中的每个单细胞上,在最佳条件下,打印机分配的液滴质量变化小于1%,几乎相同。喷射液滴的标称体积为10 pL;(f)LA−ICP−MS同位素稀释法同时测定阵列中的单细胞和液滴残留。

图2.
单细胞阵列的显微镜图像。(a)平行通道中钩形陷阱捕获的单个细胞的亮场图像。(b)去除PDMS模具后,培养皿上14×25细胞阵列的亮场图像。(c)培养皿上14×25细胞阵列的荧光图像。细胞用碘化丙啶染色。标尺:100 μm。

图3.
(a)7×10单细胞阵列的图像。(b)7×10个单细胞阵列的图像,在单个细胞上分配单个液滴后,可以获得几乎重叠的单个细胞和液滴阵列。有些液滴与单个细胞并不完全重叠。为了保证重叠阵列中单个细胞和液滴残留物的完全消融,选择更大的激光光斑尺寸(例如60μm)。标尺:100 μm。
块细胞印刷技术对LA−ICP−MS分析具有独特的优势。该技术产生的单细胞阵列位于一个浅平并开放的底物上,能达到∼90%的高占用率,且阵列中的单个细胞表现出正常的形态和较高的活力,配合使用新一代LA−ICP−MS,可将理论分析吞吐量提高到1000个细胞/秒,实现高通量分析。
2.研究引入同位素稀释分析作为一种替代校准方法。在已知量的富集同位素(峰值)加入样品并与样品混合后,精确测量同位素比率。
银比的实际最佳比例选择为0.3。单个细胞中的AgNPs和富含109Ag的液滴在血浆中同时被烧蚀,并均匀混合后,用LA−ICP−MS进行同位素稀释分析,以确定含的单细胞中的107Ag/109Ag比率,并使用同位素稀释方程计算单个细胞中的绝对Ag含量。矩阵对107Ag/109Ag比值测量的影响可以忽略。
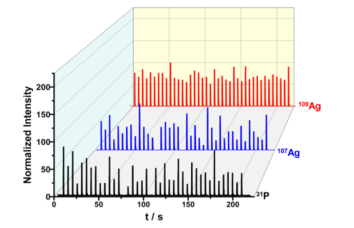
图4.
在单细胞阵列中,40个预期单细胞的31P、107Ag和109Ag的瞬态信号由LA−ICP−MS测定,结果显示,40个预期的单细胞中有38个单细胞占据。对照细胞中未发现Ag信号,提示Ag信号来自细胞摄取的AgNPs。
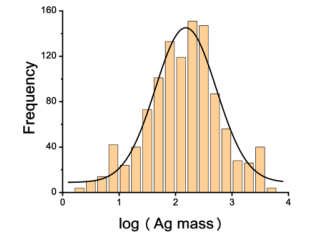
图5.
对同位素稀释样品进行LA−ICP−MS检测并计算发现,1100个单细胞的Ag质量呈近似对数正态分布。单个细胞的平均Ag质量为396±219 fg Ag/细胞,与通过酸消化和ICP−MS溶液分析测定的细胞群平均值(393 fg Ag/细胞)一致,验证了SCIDA方法的准确性。
细胞具有异质性,即使看似相同的单个细胞,在暴露于NPs后,其行为也不同,因此NPs含量也不同。与ICP−MS溶液分析只能给出整体平均值相比,SCIDA方法,它能够量化单个细胞中的NPs,显示细胞间的变化,细胞−NP相互作用和NPs的生物学效应。SCIDA方法还可进一步应用于单细胞中其他金属NPs的分析,前提是所分析元素的富集同位素可用。
总结
此研究展示了一种名为SCIDA的新方法的原理,该方法用于LA−ICP−MS对单细胞中的NPs进行定量。在SCIDA中,单个细胞被放置在阵列中,并以网格模式进行分析,因此,分析吞吐量大大提高;在没有单细胞标准物质的情况下,可以实现单细胞中NPs的精确定量,实验结果表明,SCIDA比外标校准更精确,同时操作更为便捷省时。在单细胞分析方面展现出巨大潜力,有望广泛应用于研究NP−细胞的相互作用、单细胞水平上的NPs的生物效应和毒性。
参考文献
[1] Zheng L. N., Feng L. X., Shi J. W. et. al., Single-Cell Isotope Dilution Analysis with LA-ICP-MS: A New Approach for Quantification of Nanoparticles in Single Cells. Anal Chem. 2020, 92(21):14339-14345.