1977年,Molday等人发表了使用与凝集素结合的含铁聚合物微球来分离红细胞和抗体包被的细胞。30年过去了,磁性颗粒已经确立为现代细胞生物学和免疫学定义的细胞亚群的分离标准工具,并且有不同的风格。细胞分选免疫磁珠种类繁多,不同的细胞都有不同的表面抗原受体,选择什么样的免疫磁珠?阳选还是阴性?需要几种能达到效果?哪家的免疫磁珠好?你是否有选择恐惧症呢?在这里小编推荐一款通用型抗体磁珠:抗FITC荧光素系列抗体磁珠,任何标有FITC荧光素的抗体都能与之结合,一步解决你的所有烦恼。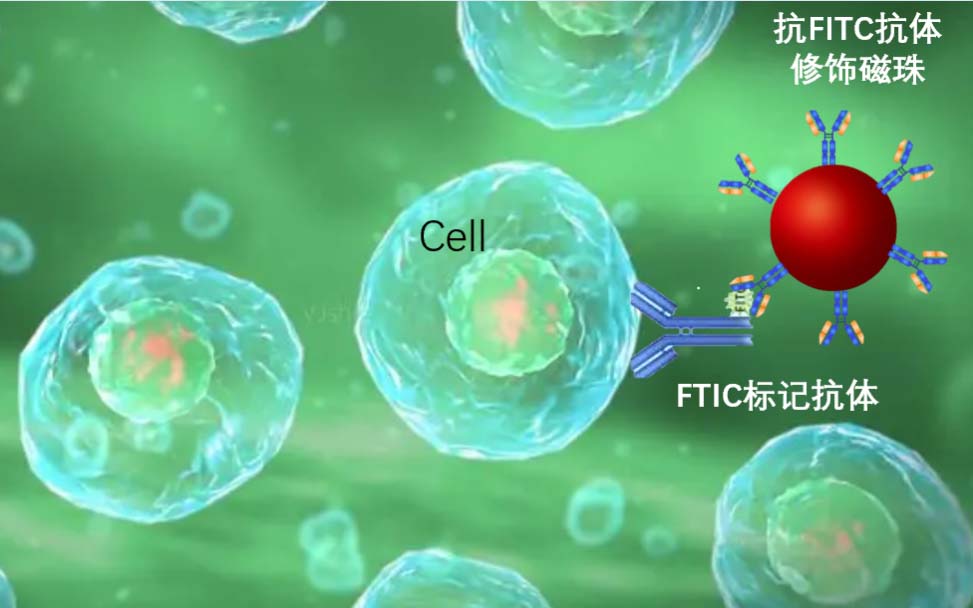
示意图:东纳生物抗FITC抗体修饰磁珠
早在1994年就有文献使用该类磁珠进行细胞分选。Stefan Barth等人(1994)用荧光异硫氰酸酯(FITC)共价标记向日葵(向日葵)分离的叶肉原生质体的质膜,随后将它们与抗FITC的特异性单克隆抗体偶联,将其与磁珠结合,并与未标记的下胚轴原生质体混合。大约95%的标记叶肉原生质体被分离,纯度大于80%。包埋在琼脂糖中的原生质体显示正常的分裂活性。2000年Hidehisa Saeki等人研究树突状细胞上的趋化因子受体(DC)和淋巴结内的趋化因子有助于将DC转运到淋巴结内的机制时使用表皮悬浮液与FITC缀合的anti-1-Ad孵育,再与抗FITC的磁珠孵育,分离鼠migDC细胞,同样的方式使用FITC-CD45R/B220从脾细胞悬液中分离出脾B细胞。
图1:小鼠LN的切片分别用FITC结合的抗CD45R/B220 (a)和FITC结合的抗CD3e (b)染色,以证明互补的B和T细胞区域的染色。(c)B细胞区(用FITC结合的抗CD45R/B220染色为绿色)和T细胞区(20×目标)内的MigDC(红色)。
2001年Lance D.等人在研究病毒感染大鼠体内干扰素变化时需要纯化自然杀伤细胞,从脾细胞悬浮液中分离NKR-P1A+CD3-细胞。先将脾细胞与FITC偶联的抗CD3一起孵育,然后与超顺磁微珠偶联的抗FITC单克隆抗体一起孵育。阴性分选掉CD3+细胞。流式细胞术显示所得CD3-细胞组分基本上不含FITC标记的细胞,将其与FITC偶联的anti-NKR-P1A孵育,然后与抗FITC微珠试剂孵育。然后用阳性分离NKR-P1A+CD3-细胞。通过流式细胞术测定自然杀伤细胞分离纯度≥90%。
图2:通过磁性细胞分选从小鼠脾脏中分离出NK (NKR-P1A1 CD32)细胞。流式细胞仪测定BN(上直方图)和F344(下直方图)细胞与FITC结合的抗NKR-P1A的染色强度,显示阳性细胞的百分比(96%)。
.
从实例中可见抗FITC荧光素磁珠非常实用,可以从组织悬液中分离出想要的细胞,也可以同时进行阳性、阴性分选出想要的细胞。为满足广大研发团队的需求,东纳生物推出系列不同尺寸的抗FITC荧光素磁珠。
✔ 高效率:使用兔源的FITC单克隆抗体,具有高亲和力、高特异性、高灵敏度,可识别更多新型表位,容易人源化等优点,分选效率高。✔ 标记无极限:可与标有FITC荧光的抗体、多肽、配体等特异性结合;阳性/阴性分选更有利。✔ 经济实用:可使用流式细胞仪上常用的抗体(FITC),抗FITC的纳米抗体磁珠分选细胞后可直接上流式,一抗体多用,节省资源。

尺寸选择指南:粒径尺寸不同分离方式也不同,各有优势。
● 微米磁珠:最易分离,磁铁即可实现,后续细胞扩增后也能通过磁铁将分离细胞和扩增细胞分开(见图3)。● PEG纳米磁珠:尺寸最小,PEG修饰稳定,生物相容性好,在磁场条件下需借助磁分离柱,可直接上流式细胞仪。● 葡聚糖纳米磁珠:尺寸略大,低非特异性,在磁场条件下需借助磁分离柱,反应体积小也可磁场分离,但时间较长。

图3:左微米磁珠分离出的Raji细胞,右为孵育72h后细胞扩增(去除磁珠结合细胞)
现提供该系列三种产品10 T试用装,每人限一种试用,具体申领方式可来电咨询或官网QQ咨询!
.
★ Barth S, Goerlich R, Schnabl H. Selection and enrichment of differentially labeled plant protoplasts. Journal of Biochemical and Biophysical Methods. 1994, 29(1): 83-86.
★ Saeki H, Wu MT, Olasz E, Hwang ST. A migratory population of skin-derived dendritic cells expresses CXCR5, responds to B lymphocyte chemoattractant in vitro, and co-localizes to B cell zones in lymph nodes in vivo. Eur J Immunol. 2000, 30(10): 2808-14.
★ Frans A. Kuypers, Rachel A. Lewis, Mandy Hua, Mary Ann Schott, Dennis Discher, Joel D. Ernst, Bertram H. Lubin, Detection of Altered Membrane Phospholipid Asymmetry in Subpopulations of Human Red Blood Cells Using Fluorescently Labeled Annexin V, Blood, 1996,3(87):1179-1187.