高通量筛选揭示纳米药物递送新规律
纳米颗粒(NPs)可封装包括小分子、生物制剂以及核酸在内的一系列治疗药物,在个性化癌症治疗方面具有巨大潜力。然而纳米药物虽然延长了活性药物的半衰期,具有降低毒性的潜力,却难以在肿瘤部位实现有效积累。通过主动靶向原理改善NPs在肿瘤中的积累所取得的成功非常有限。从根本上理解介导NPs-细胞相互作用和摄取的生物学特性可能为优化纳米载体的设计提供新思路。然而,综合评估多个NPs参数,全面了解哪种NPs特性决定了成功的运输和药物递送具有极大的挑战性。为此,美国四院院士、麻省理工学院Paula T. Hammond教授等人开发了一种高通量筛选方法——nanoPRISM,评估了多种纳米颗粒与数百种癌细胞系的关系,构建了与NPs相关的基因组相互作用网络。发现NPs内核材料是决定NPs-细胞相互作用的主要因素,SLC46A3基因具有作为预测性、NPs特异性生物标志物的价值,并进一步验证了SLC46A3是脂质NPs摄取的负调节因子。研究成果发表在最近的Science杂志上。.

示意图:nanoPRISM 筛选整合药物递送和组学。使用一个精选的纳米粒子库,同时筛选数百个癌细胞的NPs-细胞相互作用图谱。通过整合组学注释,确定了介导纳米颗粒递送至细胞的生物学特征或生物标志物。建立了运输网络,并发现了脂质纳米颗粒输送的生物调节剂。
.
为同时筛选数百个癌细胞株,以寻找NPs-癌细胞系的关联模式,作者使用了一种分子条形码方法---PRISM(profiling relative inhibition simultaneously in mixtures),用DNA条形码标记细胞系,构建了含488个带条形码的细胞系的筛选库。并设计了一个包含35种NPs的NPs库,用于确定NPs内核成分、表面化学和尺寸对NPs-细胞相互作用的影响。将细胞与荧光纳米粒孵育后,利用荧光激活细胞分类(fluorescence activated cell sorting,FACS)自适应门控策略,将荧光信号作为NPs-细胞结合程度的替代指标,并根据荧光强度将细胞分成四组,然后裂解细胞,对DNA条形码进行扩增、测序和分析(图1.A)。

图1. 同时评估数百个癌细胞系中的NPs-细胞相互作用。(A)nanoPRISM分析的示意图。荧光标记的NPs在FACS之前与混合的癌细胞一起孵育,通过NPs关联和DNA条形码测序进行下游分析。(B)动态光散射表征NPs文库的直径和zeta电位。(C)以条码计数的形式获得原始数据,每组中条码的数字分布相似。(D)考虑条形码表示中的基线差异产生了每个细胞系在特定组中被发现的概率(P)。(E)概率被折叠成每个NPs-细胞系对的单一WA。(F)将488个细胞系的WA值折叠的相似性矩阵显示了具有相同核心配方的NPs配方的集群。(G)24小时内NPs-细胞系WA值的PCA证实了基于内核成分的NPs制剂的明显聚类(左),但细胞系没有形成聚类(右)。
.
1. 癌细胞根据内核成分区分纳米颗粒
NPs内核材料是决定NPs-细胞相互作用的主要因素,而非表面化学,相同谱系的癌细胞不具有相似的NsP关联趋势(图1.F、G)。
2. nanoPRISM以高置信度鉴定了EGFR靶向化合物的相关生物标志物
研究人员比较了细胞对游离表皮生长因子受体(epidermal growth factor receptor, EGFR)抗体与通过PEG链共价结合了EGFR抗体的脂质体摄取率。发现抗体偶联脂质体的EGFR生物标志物的统计学显著性低于游离抗体(图2.A)。这表明nanoPRISM具有比较游离抗体和抗体偶联的纳米颗粒的预期生物标志物靶标的能力,在开发和优化靶向药物递送平台方面具有巨大潜力。
3.生物标志物的数量和特性受NPs性质影响
研究人员鉴定出了高度重要的生物标志物,如溶质载体转运蛋白家族。发现在ABCA1与脂质体NPs呈正相关,而多药耐药亚家族的几个成员(ABCB1/P-gp、ABCC1/MRP和ABCC4/MRP4)与PLGA NPs呈负相关。观察到脂质体表面修饰会影响生物标记的数量和重要性。具体来说,用多糖静电包被的脂质体具有最高量的相关生物标志物,而PEG化脂质体相关生物标志物的数量和重要性几乎为零。PLGA制剂无论表面修饰如何,都几乎没有生物标志物。此外,研究发现,大量重要的生物标志物与羧基化和硫酸化PS NPs相关。

图2. 相关基因组分析确定了预期的验证性生物标志物以及数百种依赖于制剂和时间的生物标志物。(A)具有高EGFR抗体结合的细胞与EGFR基因表达和蛋白质丰度密切相关。(B)单变量分析识别与NPs关联相关的基因组特征。(C)与已建立的转运、摄取和粘附基因组相关的生物标志物的显著性的热图。
4. SLC46A3是脂质体NPs摄取的负调节因子
SLC46A3是一种与脂质分解代谢相关的溶质载体(SLC)转运蛋白,可将不可降解抗体-药物偶联物(ADC)分解代谢产物从溶酶体运输到细胞质,是ADC发挥疗效的前提。本研究发现,SLC46A3负调控脂质NPs和细胞的结合(图3.C、D)。这种负调控作用仅限于脂质体NPs(图3.E),且无论癌细胞谱系如何,这种负调控作用均存在。
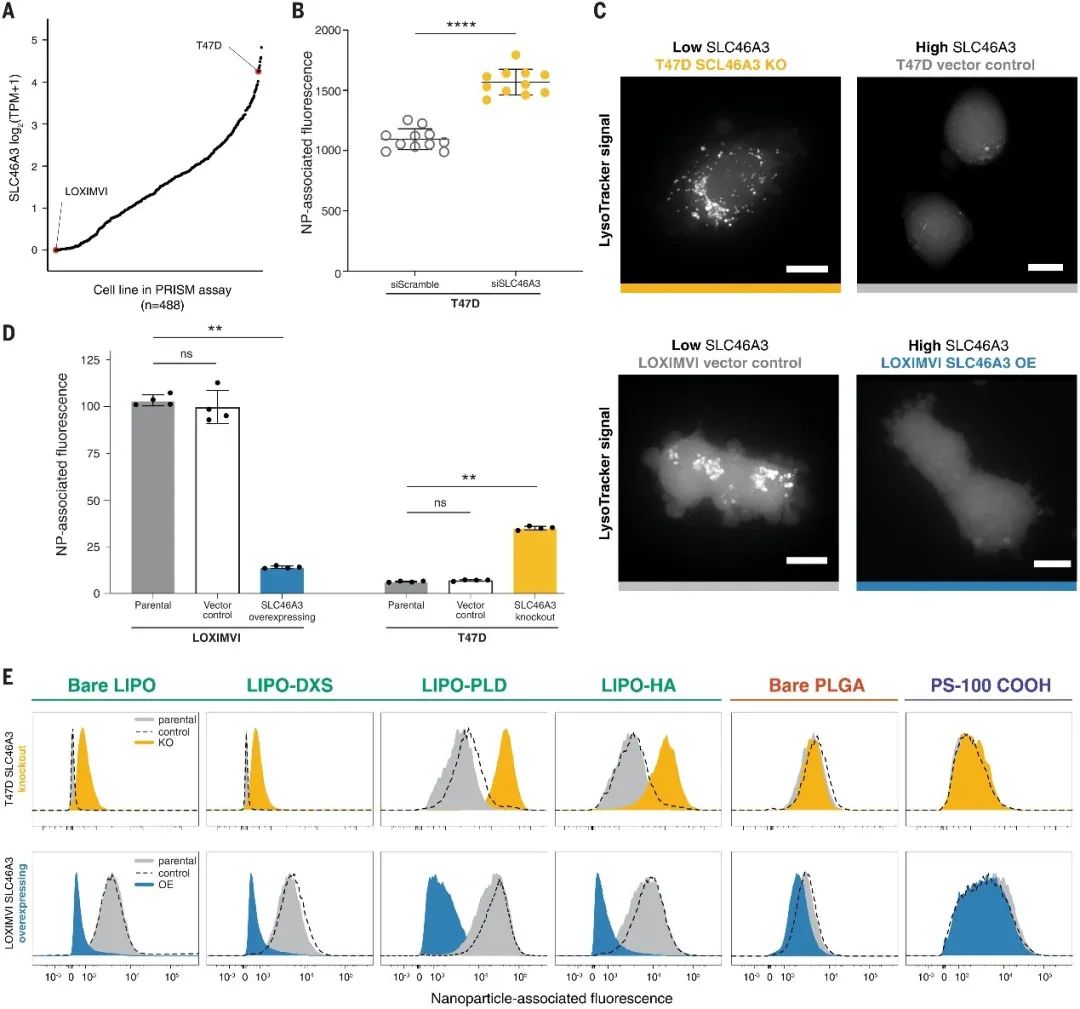
图3.调节癌细胞系中SLC46A3的表达,足以负调节与脂质体NPs制剂的相互作用。(A)在nanoPRISM细胞株库中,T47D和LOXIMVI细胞的SLC46A3表达量分别较高和较低。(B)与siRNA对照处理的T47D细胞相比,用siRNA处理以灭活SLC46A3的T47D细胞具有更高的Lipo-PLD摄取。(C)工程细胞系中Lysotracker信号的代表性显微照片显示了内溶酶体室。(D)使用慢病毒在LOXIMVI细胞中过量表达SLC46A3,使用CRISPR/Cas9在T47D细胞中永久失活SLC46A3,用流式细胞仪分析。(E)在所有测试的脂质体中一致观察到NPs关联的转变,与表面改性无关。没有观察到PLGA或PS制剂的转变。
.
5. SLC46A3负调控脂质体在体内的滞留和积聚
作者使用FDA批准的脂质体NPs制剂类似物,在体内模型中证明了SLC46A3会负影响脂质体NPs在肿瘤部位滞留和累积(图4)。SLC46A3表达同样会负影响LNP的摄取以及转染效率。这表明SLC46A3的表达是脂质NPs摄取和下游功能疗效的负调控因子和潜在生物标志物。
.

图4.聚乙二醇化脂质体(LIPO-0.3% PEG*)在LOXIMVI肿瘤中的保留和累积依赖于SLC46A3的表达。(A)通过一次瘤内注射或重复静脉注射,将荧光标记的LIPO-0.3% PEG * NPs给药于带有侧腹肿瘤的小鼠。(B)肿瘤内注射LIPO-0.3% PEG* NPs后24小时小鼠的整体动物荧光图像。(C)对侧腹肿瘤进行肿瘤内给药后24小时的LIPO-0.3% PEG* NPs滞留量进行定量。(D)在重复静脉注射后,对LIPO-0.3% PEG* NPs积累的定量。
本研究利用联合筛选和高通量测序技术,开发并验证了一个用于识别NPs与癌细胞相互作用的预测性生物标记物的平台:nanoPRISM。利用此平台,通过使用混合筛选、基因组学和机器学习算法全面研究和识别了488个癌细胞系和35个NPs间相互作用的关键参数。该集成平台的应用将促进纳米-生物相互作用的研究,对纳米载体的合理设计具有重要的指导意义。
然而,nanoPRISM依然存在一些限制。首先,本研究中主要关注的是具有转化潜力的脂质和聚合物NPs制剂,未来可再添加其他具有广泛特性的纳米材料,如可用于治疗和诊断的无机纳米材料。其次,体外筛选的结果在体内转化时往往会遇到困难,若将NPs输送指标与蛋白质组学和代谢组学等领域的数据集交互分析可能会有新的发现。Massively parallel pooled screening reveals genomic determinants of nanoparticle delivery. Science 2022.https://doi.org/10.1126/science.abm5551