研究背景
化疗的无效性、免疫抑制的肿瘤微环境(TME)是肿瘤治疗的关键挑战。此外,当肿瘤经历创伤应激时,会分化一些细胞因子和趋化因子(CXCL12),促进了肿瘤的侵袭、耐药和免疫抑制。为了克服单一治疗模式的内在局限性,多模式协同治疗逐渐得到广泛关注。多模式协同治疗借助多功能纳米平台,整合了各种治疗模式的治疗潜力,发挥了显著的协同作用,实现了“1 + 1 > 2”的效果,比单一治疗模式或其理论相加更强。
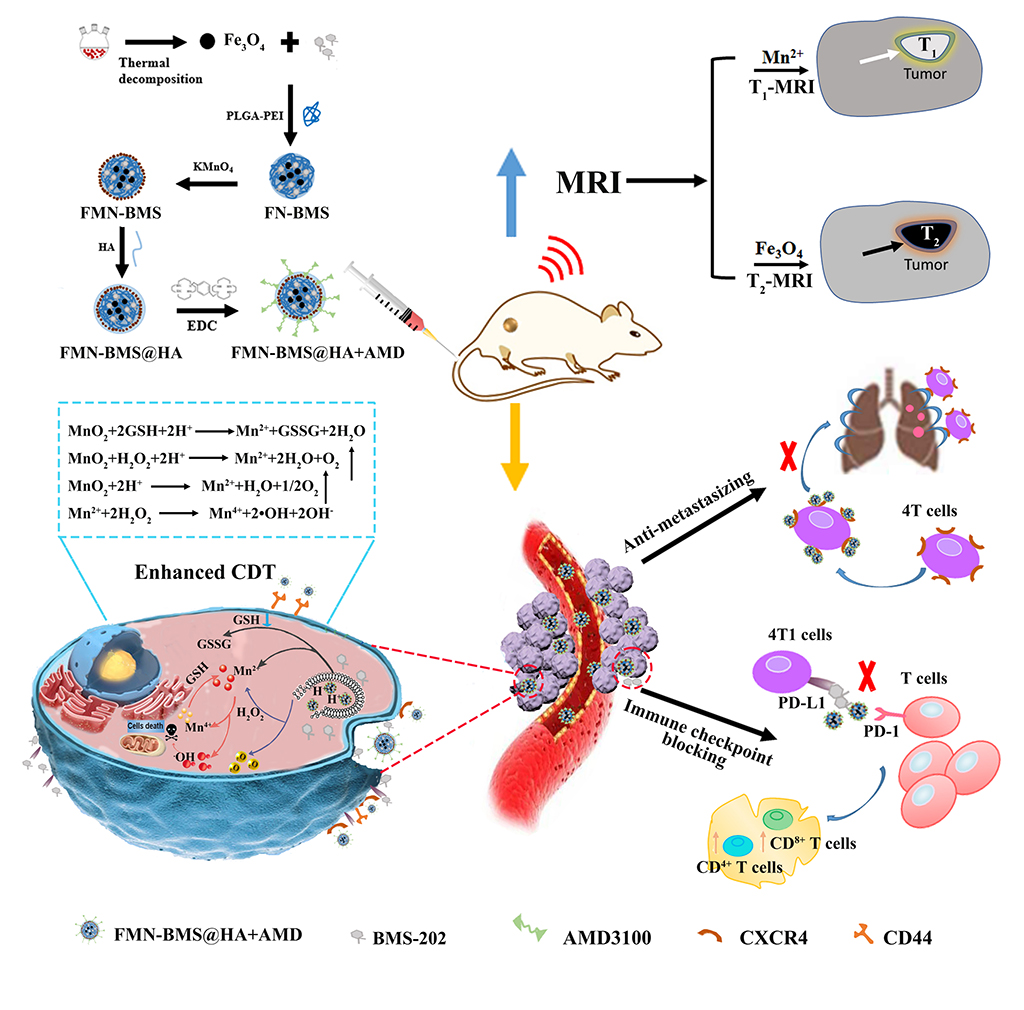
为实现多模态协同治疗,东南大学张宇教授团队设计了一个多模态协同治疗纳米平台(CDT/免疫治疗/抗转移/双模MRI肿瘤成像)。首先在聚乳酸-羟基乙酸基纳米颗粒核心中加载Fe3O4和BMS-202 (PD-L1抑制剂),并进一步在其表面原位合成了MnO2壳层,构建出载药Fe/Mn复合磁性纳米颗粒。随后,分别用透明质酸(HA)和AMD3100 (CXCR4拮抗剂)靶向包覆金属有机复合纳米颗粒,从而实现多模态协同治疗纳米平台(FMN-BMS@HA+AMD)的构建。该纳米平台优先靶向至肿瘤区域,基于肿瘤微环境,MnO2与GSH发生氧化还原反应生成Mn2+,导致GSH耗竭,从而增强化学动力治疗(CDT)效应。同时,MnO2对H2O2具有较高的催化活性,在缓解缺氧中发挥重要作用。此外,通过阻断CXCR4/CXCL12及PD-1/PD-L1轴,阻止肿瘤转移,提高免疫治疗效果。并且该纳米平台可通过T1-T2双模磁共振成像同步实现肿瘤成像(图1)。研究成果发表在Nano Today上,题为:A versatile metal–organic nanoplatform in combination with CXCR4 antagonist and PD-L1 inhibitor for multimodal synergistic cancer therapy and MRI-guided tumor imaging
图1. 多模式诊疗纳米平台(FMN-BMS@HA+AMD)的合成及协同抗肿瘤治疗示意图。
研究重点
FMN-BMS@HA+AMD的合成与表征
作者成功制备了一种能够提高化学动力学治疗效果,并且能抑制转移及增强免疫治疗的多功能纳米平台(FMN-BMS@HA+AMD)(图2)。该纳米平台具有较好的分散性,呈球形,表面有MnO2纳米壳层,平均粒径大约为94.6 ± 19.8 nm。在pH为6.5和5.5酸性条件下,BMS-202质子化转变为亲水状态,释放速率加快。此外,该纳米平台在酸性条件下(pH为6.5和5.5)具有降解行为,Mn2+释放更快。pH引发的FMN-BMS@HA+AMD纳米颗粒降解遵循公式(1)。
MnO2+2H+→Mn2++ H2O + 1/2O2 (1)
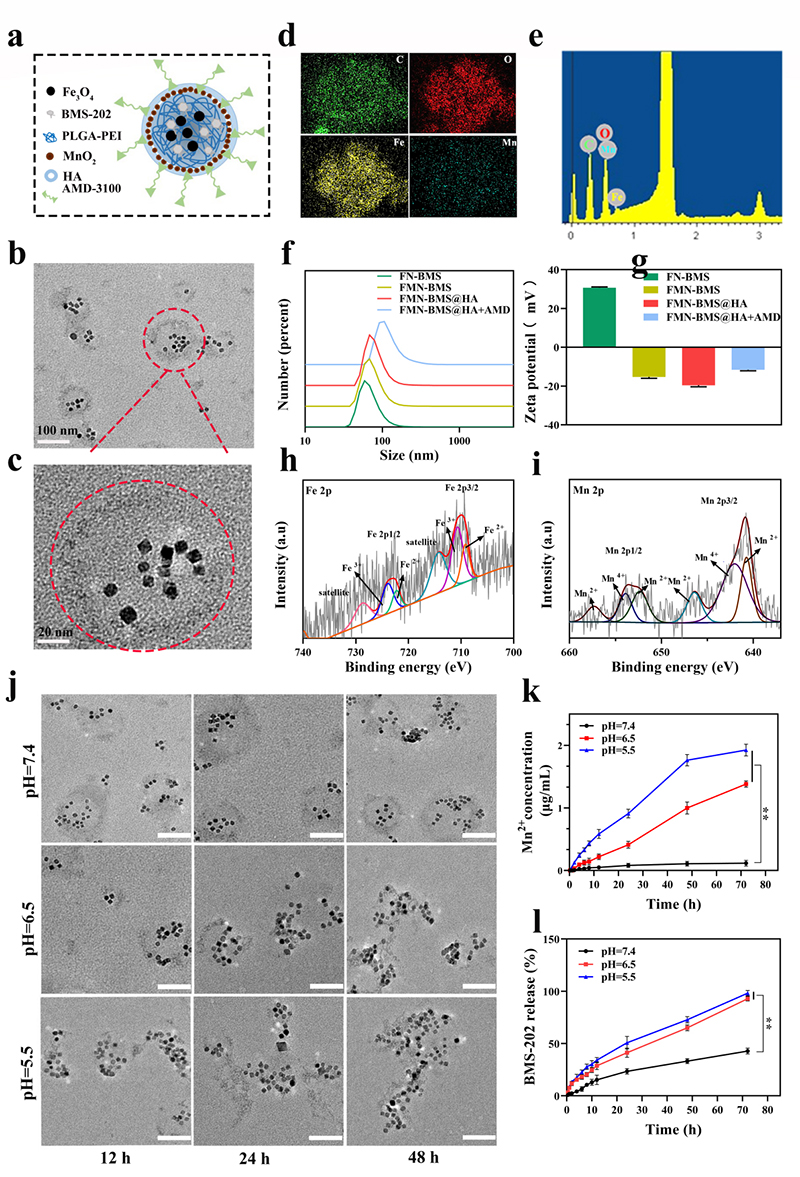
图2. FMN-BMS@HA+AMD的表征。(a) FMN-BMS@HA+AMD的示意图;(b,c) FMN-BMS@HA+AMD的透射电子显微镜图像;(d) FMN-BMS@HA+AMD的EDS元素Mapping图;(e) FMN-BMS@HA+AMD的EDS图;(f)纳米粒子的水动力尺寸;(g)不同制备阶段的纳米粒子的Zeta电位;FMN-BMS@HA+AMD的高分辨率(h) Fe2p和(i) Mn2p XPS光谱。(j)不同条件下FMN-BMS@HA+AMD降解的透射电子显微镜图像。比例尺= 100 nm。(k) 不同pH条件下Mn2+释放。(l) BMS-202的释放。(*, p < 0.05; **, p < 0.01)
FMN-BMS@HA+AMD的pH,GSH和H2O2响应性能
为研究该纳米平台的催化性能,作者对其产氧能力、GSH消耗能力及羟基自由基产生进行了测试(图3)。通过溶解氧仪证明该纳米平台具有较强的产生氧气的能力,并且存在浓度依赖性。同时,该纳米平台能够消耗GSH,产生·OH。其催化原理遵循公式(2-4)
Mn2++H2O2 → Mn4+ + •OH (2)
MnO2+2GSH+2H+→Mn2++GSSG+2H2O (3)
MnO2+H2O2+2H+→Mn2++ H2O + O2 (4)
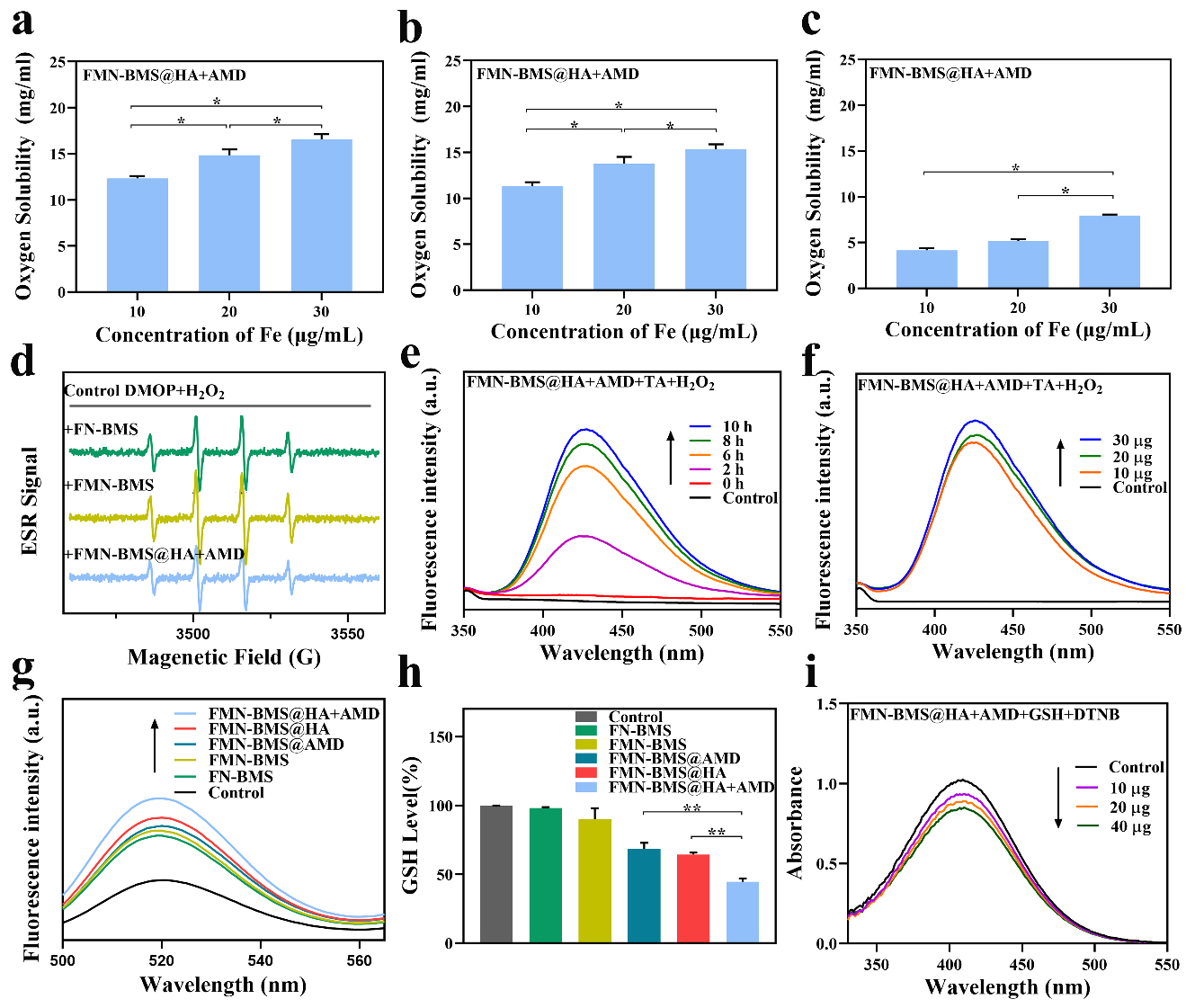
图3.双靶向FMN-BMS@HA+AMD的催化性能。(a, b, c) 不同浓度下纳米平台氧溶解度的pH依赖性(从左到右依次为:pH=5.5, pH=6.5, pH=7.4);(d) ESR光谱;(e, f) 使用TA作为•OH指示剂,在pH 5.5和H2O2孵育纳米粒子后•OH的生成;(g) 处理4T1细胞4 h后ROS水平的荧光光谱检测;(h)不同纳米颗粒的体外谷胱甘肽消耗。(i) 在10 mM GSH和DTNB (GSH的指示剂)存在下,吸收光谱随纳米粒子浓度(Fe的浓度)增加而变化。(*, p < 0.05; **, p < 0.01)
FMN-BMS@HA+AMD纳米颗粒体外抗肿瘤能力
FMN-BMS@HA+AMD通过表面的HA和AMD3100有效的靶向并进入到乳腺癌肿瘤细胞(图4a-c)。通过催化活性,催化H2O2转化为剧毒·OH,有效杀伤肿瘤细胞(图4d,e)。同时,该纳米平台由于MnO2在酸性条件下及H2O2存在时催化产生氧气,导致缺氧环境的缓解,HIF-1α表达下降(图4f,g)。此外,AMD3100作为CXCR4/CXCL12生物轴小分子抑制剂,可干扰CXCR4/CXCL12信号通路,有效阻止乳腺癌细胞的迁移(图4h,i)。

图4.体外抗肿瘤活性。(a) FITC标记的纳米颗粒处理4T1细胞4 h的CLSM图像。比尺= 10 μm;(b、c) 流式细胞术检测FITC标记的不同纳米颗粒孵育4T1细胞4 h;(d) 纳米颗粒处理4T1细胞4 h后的荧光图像,Calcein-AM染色的活细胞产生强烈的绿色荧光;死亡细胞经PI染色后形成鲜红色荧光。比例尺= 20 μm;(e) CCK-8法检测不同纳米颗粒处理4T1细胞48 h后的细胞计数;(f) 流式细胞术检测不同处理后体外4T1细胞HIF-1α水平;(g) 流式细胞术结果统计直方图;(h) Transwell小室示意图(左)和(i)不同纳米颗粒对4T1癌细胞迁移的影响(右)。(*, p < 0.05; **, p < 0.01)
FMN-BMS@HA+AMD的活体双模态MRI
在治疗过程中,监测肿瘤的治疗效果对优化治疗策略至关重要。本文中分析了不同纳米颗粒在体内的MRI行为。通过尾静脉注射纳米颗粒到4T1乳腺癌雌性BALB/c小鼠体内,基于释放的Mn2+获得T1加权成像,并从Fe3O4纳米粒子获得T2加权成像(图5)。FMN-BMS@HA+AMD组肿瘤区域的T1加权信号强度在2 h时达到最高,此外,随着时间的延长,不同纳米颗粒在T2加权成像中表现出更强的信号强度。

图5.体内磁共振成像。(a)小鼠MRI示意图。(b)荷瘤小鼠(红色虚线圈)注射不同纳米颗粒前后的T1加权MR图像和T2加权MR图像。
FMN-BMS@HA+AMD的体内抗肿瘤作用及免疫反应调节
本文成功构建了小鼠乳腺癌模型去验证FMN-BMS@HA+AMD在体内的治疗效果(图6)。FMN-BMS@HA+AMD显著提高了乳腺癌治疗效果,与对照组(生理盐水组)相比,明显延长了小鼠的生存期,50天后仍有60.0%的存活率,肿瘤质量仅为0.2 g。此外,本文进一步对小鼠肺部进行切片,并通过H&E染色和Ki-67免疫组化进行分析,以显示转移阳性区域。其中,含AMD3100的处理组Ki-67的表达明显低于其他处理组,FMN-BMS@HA+AMD在体内有效地抑制了肿瘤的迁移。
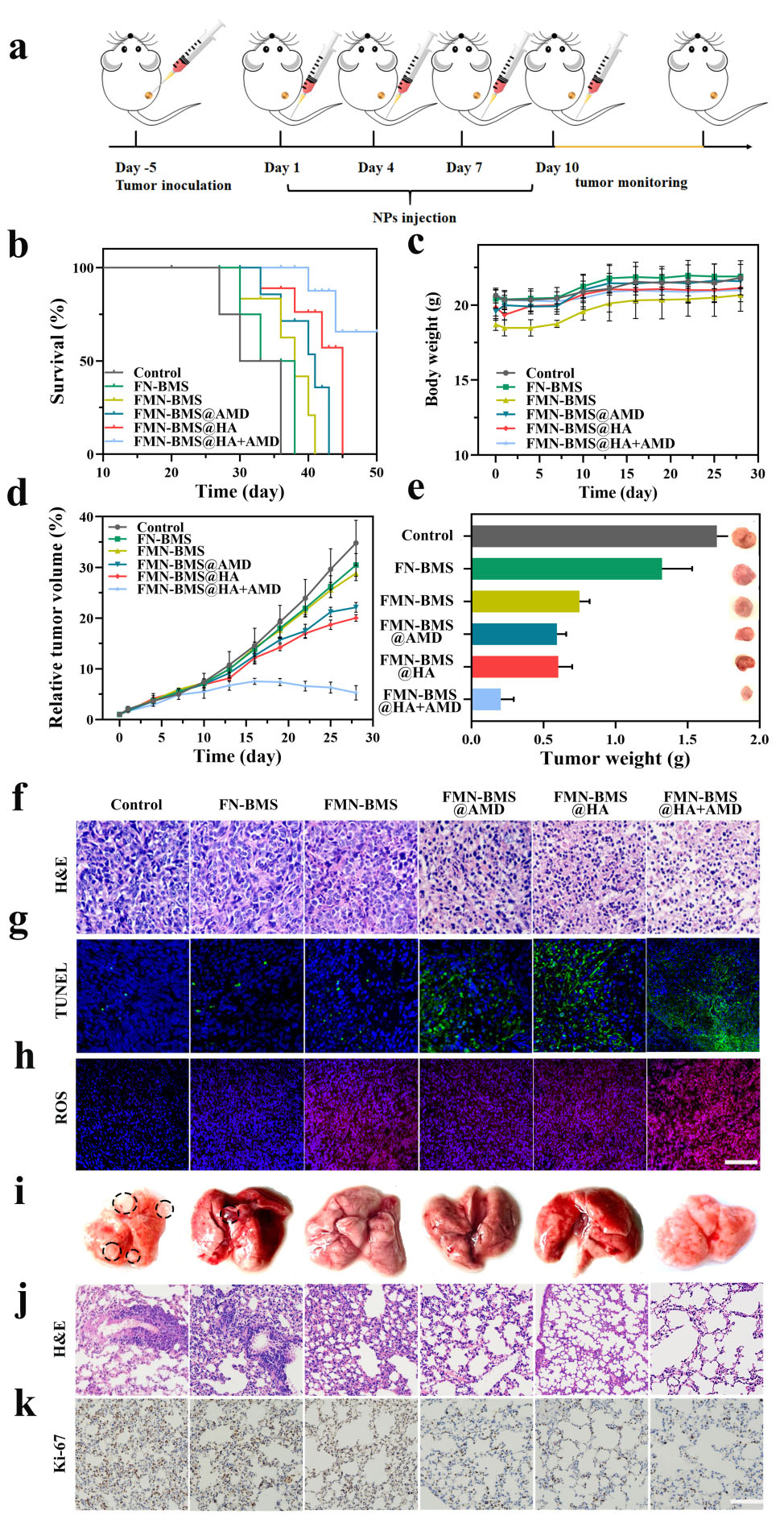
图6.纳米粒子的体内治疗作用。(a) 针对皮下移植肿瘤的治疗示意图;(b)不同处理4T1荷瘤BALB/c小鼠的生存曲线;(c) 4T1荷瘤BALB/c小鼠不同治疗后体重变化情况;(d、e) 不同处理4T1荷瘤BALB/c小鼠肿瘤体积和质量的变化;(f)不同处理后肿瘤组织的代表性he染色图像,比例尺= 100 μm;(g) 肿瘤切片TUNEL染色显示不同的细胞凋亡,比例尺= 100 μm;(h) 显示治疗后肿瘤中ROS表达的肿瘤切片免疫荧光染色显微图,比例尺= 100µm;(i, j) 不同处理后的肺代表性照片和肺组织病理切片的he染色;(k)不同处理后肺组织Ki-67免疫组化分析,比例尺= 100 μm。
接下来,进一步评估了FMN-BMS@HA+AMD是否能促进体内T细胞的治疗效果。首先对肿瘤内缺氧情况及PD-L1的表达进行了测试,与生理盐水组和FN-BMS组相比,携带MnO2壳层的纳米颗粒处理的小鼠HIF-1α信号显著降低(图7b)。缺氧的缓解有望逆转免疫抑制的TME,并促进肿瘤化学免疫治疗。同时,由于BMS-202的存在,治疗组的PD-L1表达均有所下降(图7c)。我们评估了FMN-BMS@HA+AMD调控的肿瘤免疫治疗在TME中的总体免疫效果。FMN-BMS@HA+AMD治疗组较其他组相比,细胞毒性T淋巴细胞(CD8+)和辅助性T细胞(CD4+)均有更高的增强。值得注意的是,FMN-BMS@HA+AMD治疗组的CD8+ T细胞数量是生理盐水组的13.6倍。这些结果表明,FMN-BMS@HA+AMD可以通过增强CD4+和CD8+ T细胞的数量和活化来有效抑制肿瘤的生长。
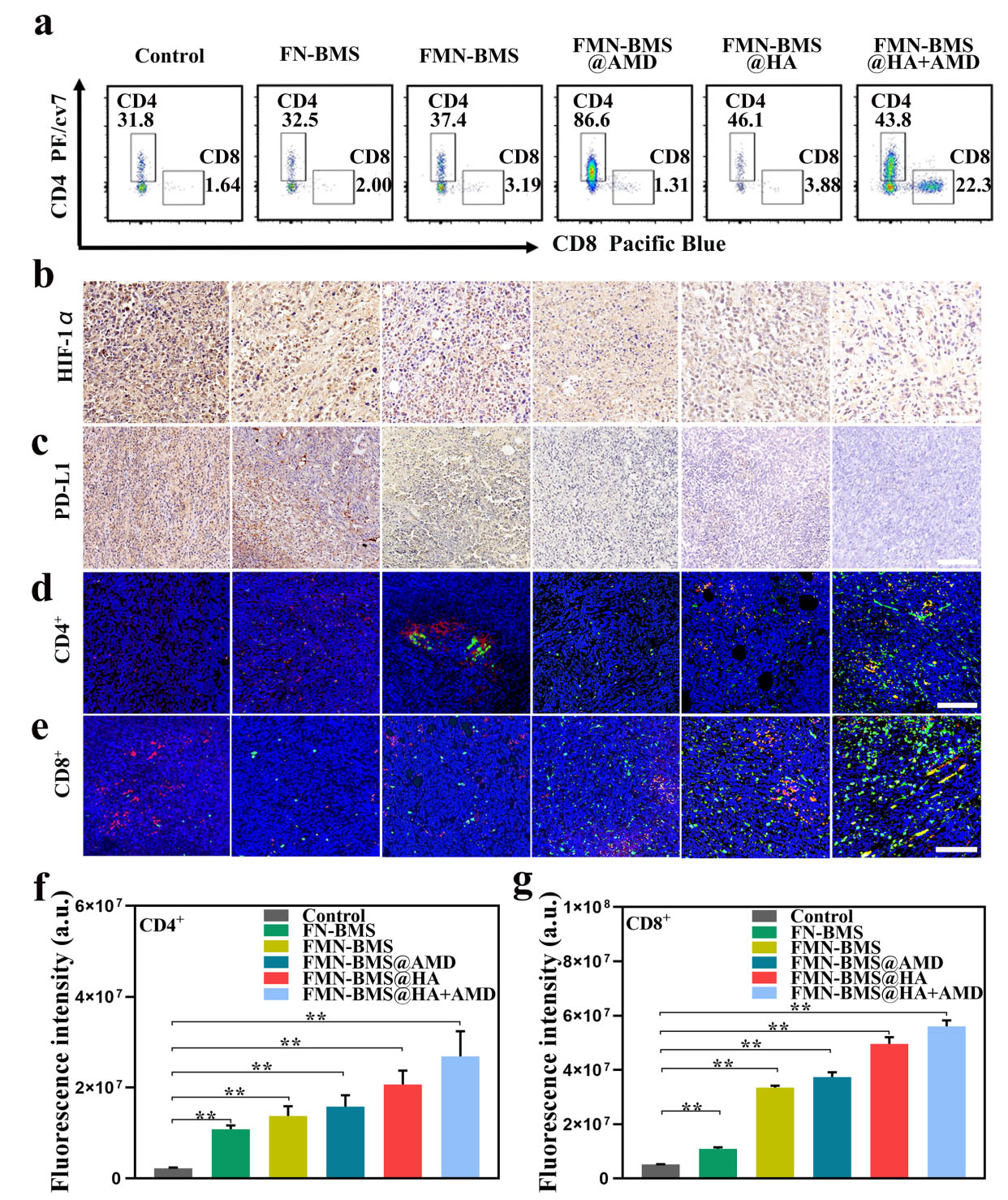
图7. 体内免疫治疗效果评估。(a) 采用流式细胞术分析体内CD4+和CD8+ T细胞的定量比例;(b、c) 移植瘤组织中HIF-1α和PD-L1的免疫组化分析;(d, e) 肿瘤切片免疫荧光染色显微镜图像,显示治疗后肿瘤中CD4+和CD8+的表达。比例尺= 100µm;(f, g) CD4+和CD8+免疫荧光定量分析(*, p < 0.05; **, p < 0.01)。
总结与展望
本研究开发了一种多模态协同治疗纳米平台(FMN-BMS@HA+AMD),并在乳腺癌动物模型中表现出显著的肿瘤生长和转移抑制作用。FMN-BMS@HA+AMD能够增强CDT效应,逆转免疫抑制TME和阻断CXCR4/CXCL12生物轴。同时,肿瘤组织中缺氧诱导因子(HIF-1α)和PD-L1表达下调,CD4+和CD8+ T细胞比例上调,增强了免疫治疗效果。此外,多模态协同纳米平台生成的Fe3O4和Mn2+提供了T1-T2双模态MRI,实现了诊疗一体化。尽管FMN-BMS@HA+AMD优异的治疗和诊断特性已经在本文目前的研究数据中得到了证实,这一多模式诊疗纳米平台的效用仍有待通过其他原发肿瘤模型进一步评估和证实。