应用案例│磁性纳米颗粒和静态磁场对骨髓间充质干细胞的刺激:
释放外源性miR-1260a可促进成骨和血管生成
骨修复的治疗目前仍面临巨大挑战,自体和异基因移植两种标准临床治疗方法因供应有限、供区并发症等限制无法广泛应用。
骨髓间充质干细胞(BMSCs)是促进骨缺损修复中的成骨和血管生成的有吸引力的潜在治疗剂。而来源于干细胞的外泌体,由于可以发挥与干细胞相似的旁分泌功能,并且能克服干细胞移植的局限性,引起广泛关注。
来自骨髓间充质干细胞的外泌体(BMSC-Exos)已被证实可促进成骨和血管生成。磁性纳米颗粒(如Fe3O4,γ-Fe2O3)与静磁场(SMF)相结合通常用于促进伤口愈合和骨再生。因此,本研究旨在评估经低剂量Fe3O4纳米颗粒(南京东纳生物科技有限公司)和/或SMF预处理的骨髓间充质干细胞衍生的外泌体是否在骨再生中发挥优异的促成骨和促血管生成活性,以及相关的潜在机制。
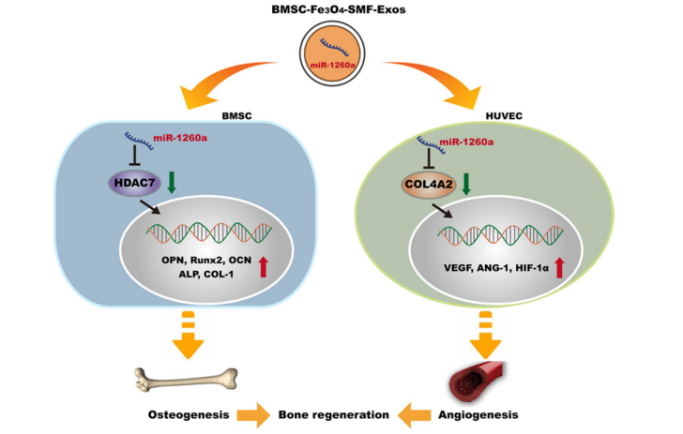
图1. 源自BMSC-Fe3O4-SMF-Exos外泌体的miR-1260a通过靶向HDAC7促进成骨,并通过靶向COL4A2促进血管生成1.将骨髓间充质干细胞(BMSCs)分别培养在含有不同浓度Fe3O4纳米颗粒(0、25、50、100和200 µg/mL)的培养基中,并暴露于不同强度(0、50、100和200 mT)的静磁场(SMF),以确定BMSCs生长增殖的最佳刺激条件。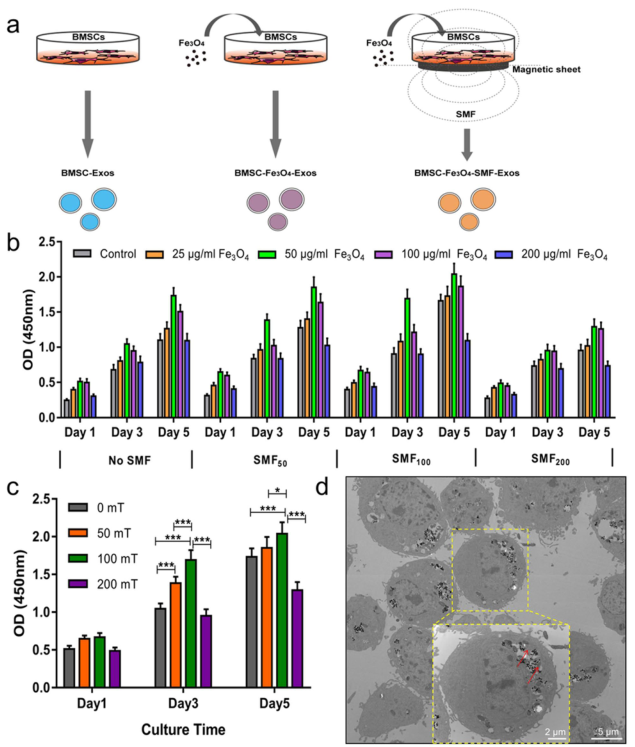
图2. 不同培养条件下骨髓间充质干细胞的增殖测试。CCK-8检测结果显示,50 µg/mL Fe3O4纳米颗粒和100 mT SMF的条件更适合BMSCs的生长和增殖,作为研究的最佳浓度和强度。透射电镜结果显示,BMSCs吸收磁性纳米颗粒(MNPs)后,MNPs分布在细胞核和细胞质中,BMSCs的形态没有显著变化。2.对BMSC-Exos、BMSC-Fe3O4-Exos和BMSC-Fe3O4-SMF-Exos三种外泌体进行表征和内化,比较研究三者的形态、大小、数量以及BMSCs和HUVECs的吸收。
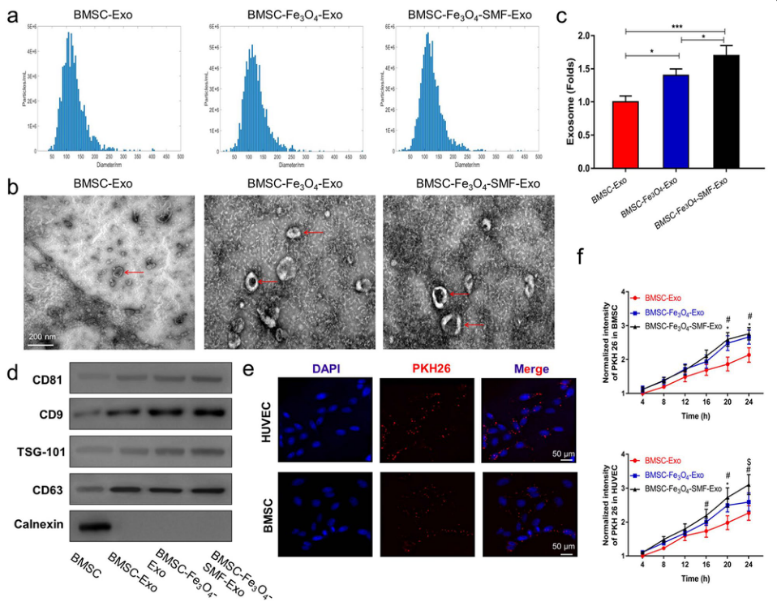
图3. 三种类型外泌体的表征和内化。纳米粒子跟踪分析(NTA)的结果表明,三组外泌体中的颗粒大小主要在52至168 nm之间。TEM图像显示出相似的杯状或球形形态。Fe3O4纳米颗粒和SMF增加BMSCs中外泌体的产生。Western印迹分析的结果证实,所有外泌体都存在外泌体特异性标记。使用荧光显微镜实时监测BMSCs和HUVECs对红色荧光染料(PKH26)标记的外泌体的摄取速率,结果表明,BMSC-Fe3O4-SMF-Exos和BMSC-Fe3O4-Exos更容易被BMSCs和HUVEC吸收。
3. 使用体内的临界大小的颅骨缺损大鼠模型,将BMSC-Fe3O4-SMF-Exos和BMSC-Fe3O4-Exos的成骨和血管生成活性与BMSC-Exos和对照组进行比较研究。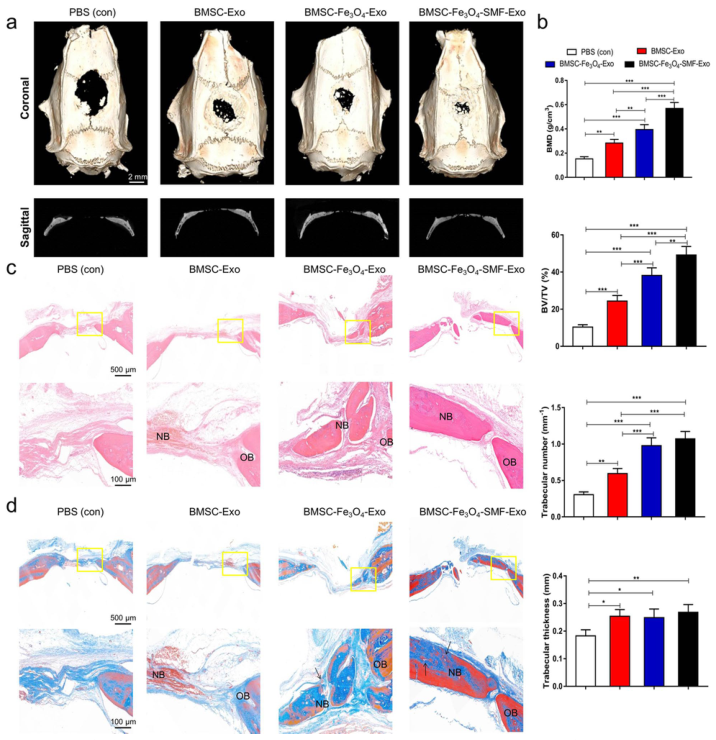
图4. 外泌体促进体内骨再生和血管生成。在临界大小的颅骨缺损大鼠模型中,通过显微CT图像以及对新形成的骨的定量分析,结果显示由Fe3O4和SMF处理后的外泌体组的新形成的骨填充缺损区域、骨密度、BV/TV比率和骨小梁数量均显著高于其他两组,表明由Fe3O4和SMF处理后的外泌体提高了体内的骨愈合能力。HE染色结果显示,Fe3O4和SMF处理后的外泌体组有更多新形成的骨。Masson染色结果显示,BMSC-Fe3O4-SMF-Exo中的胶原形成多于其他三组。此外,在BMSC-Fe3O4-SMF-Exo和BMSC-Fe3O4-Exo组中,可以在新形成的骨周围发现更多脉管系统结构。
4. 最后,通过对外源性miRNA进行测序,探索了促进骨再生的潜在分子机制。含有miR-1260a的BMSC-Fe3O4-SMF-Exos被BMSCs和HUVECs内化,miR-1260a通过靶向3′-UTR调节HDAC7和COL4A2。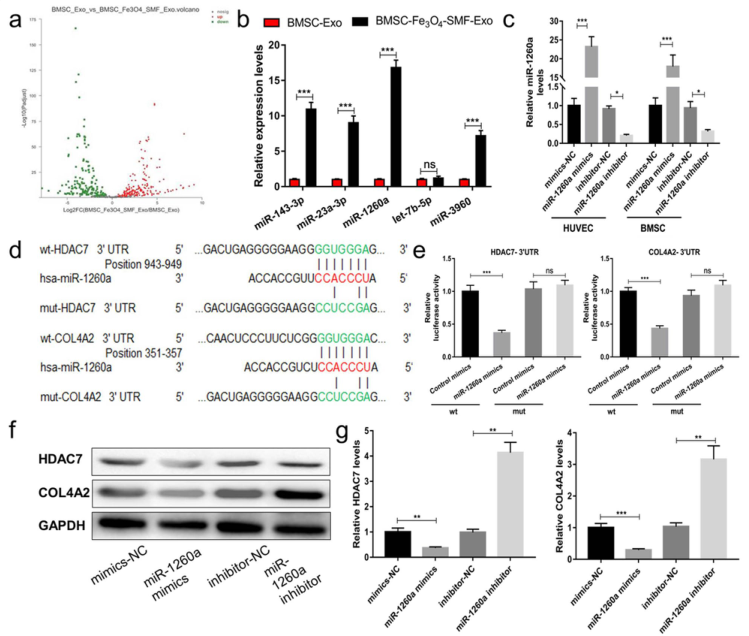
图5. 源自BMSC-Fe3O4-SMF-Exos的miR-1260a调节HDAC7和COL4A2,从而促进成骨和血管生成。对BMSC-Exos和BMSC-Fe3O4-SMF-Exos进行了miRNA测序分析,选择前五位上调的miRNA并使用qRT-PCR验证了有四种miRNA(miR-143-3p、miR-23a-3p,miR-1260a和miR-3960)在BMSC-Fe3O4-SMF-Exos中显著上调。Western印迹分析显示,miR-1260a模拟物增强了成骨和血管生成蛋白的表达水平,而pcDNA-HDAC7和pcDNA-COL4A2减弱了这些水平,一系列救援实验的结果表明,BMSCs中的pcDNA-HDAC7和HUVECs中的pcDNA-COL4A2可以消除外体miR-1260a模拟物对成骨和血管生成的促进作用。
﹀
﹀
﹀
总 结
通过以上实验,研究人员证明了经Fe3O4纳米颗粒与SMF联合预处理的BMSCs释放的外泌体中miR-1260a的丰度显著增加,并表明BMSC-Fe3O4-SMF-Exos可被BMSCs和HUVECs吸收。在BMSCs中,miR-1260a与HDAC7 mRNA的3′-UTR结合,并直接抑制其表达。类似地,在HUVEC中,COL4A2 mRNA的3′-UTR与miR-1260a结合,并且COL4A2的表达被miR-260a抑制。本研究证明了BMSC-Fe3O4-SMF-Exos和BMSC-Fe3O4-Exos可以促进血管生成和成骨的协同调节,并且是优化治疗方案的有效和有前景的方法。
﹀
﹀
﹀
参考文献:
[1] Wu D., Chang X., Tian J. et. al., Bone mesenchymal stem cells stimulation by magnetic nanoparticles and a static magnetic field: release of exosomal miR-1260a improves osteogenesis and angiogenesis. J Nanobiotechnology. 2021, 19, 209.
始于微纳 止于至善
地址:南京市龙眠大道568 号,南京生命科技小镇5号楼,电话:025-83475811
网址:www.nanoeast.net
南京东纳生物科技有限公司