研究背景:
Anti-PD-L1(抗PD-L1,简称aPD-L1)免疫检查点阻断疗法已成为各种晚期实体瘤的一种有前景的治疗方法。然而,受肿瘤微环境限制的aPD-L1抑制剂的作用使大多数患者表现出该免疫疗法耐药性。鉴于当前抗PD-1/PD-L1治疗的显著限制,迫切需要探索能够有效增强抗PD-1/PD-L1治疗效果的方法。最近,来自于广西医科大学肿瘤医院放射科的金观桥课题组将Sialyl Lewis X与氨基聚乙二醇修饰的超小超顺磁性氧化铁(USPIO-PEG-NH2,购自南京东纳生物有限公司)偶联,形成UPS纳米颗粒(USPIO-PEG- slex,称为UPS)用于增强抗PD-L1免疫治疗。结果表明:在体外实验中,UPS具有较强的光热治疗(PTT)能力,并能刺激5种免疫相关细胞通路。在体内,当光热治疗辅助aPD-L1治疗时,CD4+ T细胞浸润显著增加14.46倍,CD8+ T细胞浸润增加14.79倍,肿瘤坏死因子α和干扰素γ分泌升高。与单独使用aPD-L1相比,这种PTT辅助aPD-L1治疗对原发肿瘤和远端肿瘤均有显著的抑制作用。工作发表在International Journal of Nanomedicine(IF=7.033)。
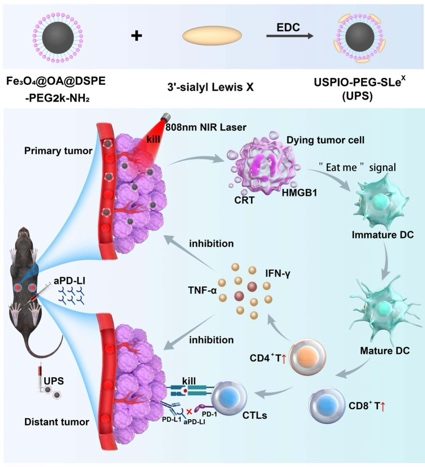
图1:UPS纳米颗粒的合成以及在肿瘤部位的特异性积累,促进PTT并增强aPD-L1免疫疗法机理示意图
本文重点:
01
纳米颗粒的制备和物理化学特性
纳米治疗剂UPS(USPIO-PEG-SLex)通过聚乙二醇修饰的超小型超顺磁性氧化铁纳米颗粒(Fe3O4@OA@DSPE-PEG2k-NH2 )与SLex通过酰胺化反应合成方法制备。采用高分辨率透射电子显微镜(TEM)评估UPS的尺寸和形态,发现这些纳米颗粒具有一致的尺寸和形状,平均直径约为10 nm,展示出良好的制备可重复性和预期的治疗效果。通过专用的纳米粒径和Zeta电位分析仪(Zetasizer)测量,发现USPIO-PEG和UPS的水动力直径分别为20.91 ± 0.50 nm和42.38 ± 1.07 nm,Zeta电位从USPIO-PEG的-7.58 mV变化到UPS的-22.11 mV,表明成功的SLex修饰和良好的分散性。通过振动样品磁强计(VSM)分析,UPS纳米颗粒显示出良好的超顺磁性,其饱和磁化强度(Ms)为0.18 emu/mL,证明其作为磁共振成像(MRI)对比剂的潜力。UV-vis-NIR吸收光谱分析表明,UPS纳米颗粒在近红外区域有广泛的吸收带,且吸收强度随颗粒浓度增加而提高。这些特性使得UPS纳米颗粒成为有效的光热治疗剂。

图2:UPS纳米颗粒的理化性能表征
02
体外细胞吸收与治疗效果
研究通过TEM和流式细胞术等技术手段,探究了UPS纳米颗粒被人鼻咽癌细胞(5–8F细胞)的摄取以及光热治疗效果。主要发现如下:
细胞摄取:UPS纳米颗粒被5–8F细胞高效摄取,TEM图像显示纳米颗粒进入细胞内部,ICP-OES分析确认了高铁含量,表明Slex的加入增强了细胞内摄取。
光热治疗诱导细胞死亡:流式细胞术结果表明,UPS纳米颗粒联合近红外激光照射显著增加了细胞死亡率,证明了其光热治疗的有效性。
线粒体功能损伤:JC-1染色揭示,经治疗的细胞显示出线粒体膜电位的显著变化,指示线粒体功能损伤和细胞凋亡的发生。
抑制细胞迁移:细胞划痕实验结果显示,光热治疗显著抑制了5–8F细胞的迁移能力,进一步证实了其抗肿瘤效果。
这些结果表明,UPS纳米颗粒在体外对人鼻咽癌细胞具有显著的光热治疗效果,包括增强细胞吸收、诱导细胞凋亡以及抑制细胞迁移,展现了其作为光热治疗剂的潜力。
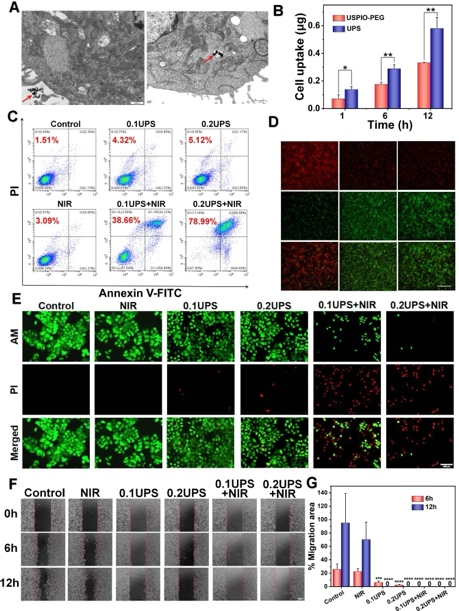
图3:肿瘤细胞摄取UPS纳米颗粒以及体外抗癌作用
03
基因表达分析
研究通过全基因组RNA测序对5-8F细胞进行了分析,以评估UPS纳米颗粒介导PTT的细胞毒性机制及其潜在的免疫激活机制。研究检查了16,728个基因的转录情况,其中624个基因在PTT处理的细胞中被转录。与PBS对照组相比,PTT组中有87个基因表现出上调。
具体的分析结果包括使用维恩(Venn)图来展示各个处理组内基因转录模式的比较,火山图可视化差异表达基因(DEGs),而无差异表达的基因则被标记为无DEGs。通过KEGG通路分析,研究揭示了光热治疗激活了多个与免疫相关的通路,包括RIG-I样受体信号通路、B细胞受体信号通路、内质网中的蛋白质加工、Jak-STAT信号通路以及肿瘤坏死因子(TNF)信号通路。热图展示了差异表达基因,以及构建的展示蛋白-蛋白相互作用网络图,特别指出了属于热休克蛋白家族的红色文本。
这些结果表明,UPS纳米颗粒介导的PTT不仅能够诱导细胞死亡,还能通过激活免疫相关基因和促进树突状细胞成熟作为抗原进一步激活免疫系统,揭示了其在免疫调节中的潜在应用价值。
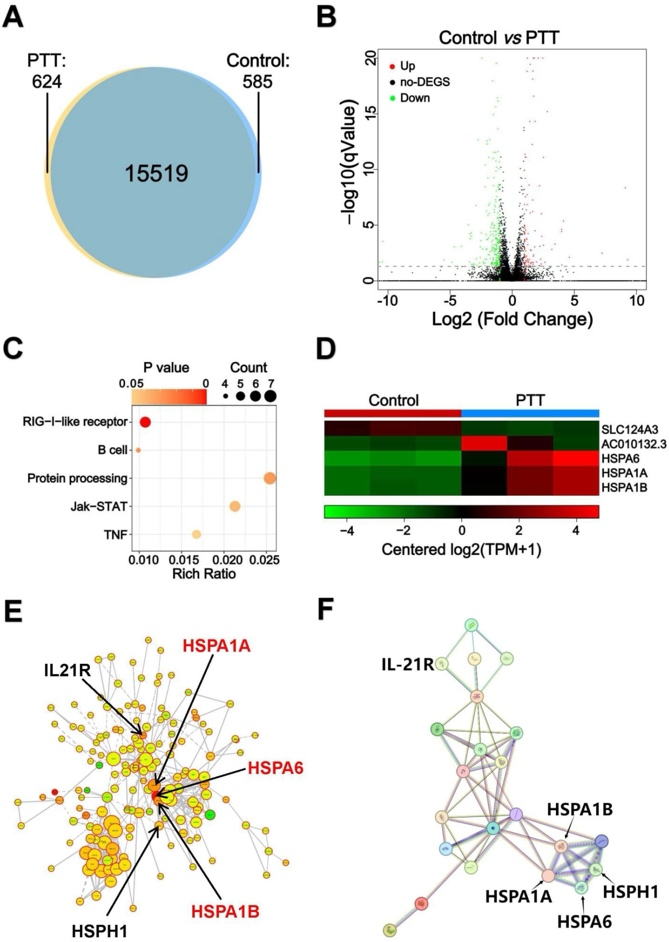
图4:在808 nm激光(2.1 W cm-2)照射下,用200μg mL−1UPS纳米颗粒处理人鼻咽癌细胞的转录组测序分析示意图
04
体内光热治疗及其对抗PD-L1免疫治疗增效作用
体内光热治疗及其对抗PD-L1免疫治疗增效作用的研究展示了使用UPS进行PTT与抗PD-L1治疗相结合以增强抗癌效果的策略。研究通过在双侧鳞状细胞癌7(SCC7)皮下肿瘤模型中评估UPS纳米颗粒介导的单独PTT及其联合PD-L1免疫检查点阻断治疗的抗肿瘤效果,发现此组合策略不仅有效抑制了原发肿瘤的生长,还显著提高了抗肿瘤免疫应答。具体而言,PTT+aPD-L1处理组在肿瘤细胞膜上展示了最强的荧光强度,暗示UPS纳米颗粒基于PTT增强了aPD-L1免疫治疗,触发了更多的肿瘤细胞免疫原性细胞死亡(ICD),并有效促进了肿瘤中钙网蛋白(CRT)和高迁移率族蛋白B1(HMGB1)的表达。
此外,研究还探讨了T淋巴细胞的肿瘤内浸润,包括细胞毒性T淋巴细胞(CTLs,CD8+)和T辅助细胞(CD4+),发现PTT+aPD-L1组中CD8+ T细胞和CD4+ T细胞的平均荧光强度分别是aPD-L1组的14.79倍和14.46倍。这些结果表明,基于UPS纳米颗粒的PTT显著刺激了CD8+和CD4+ T细胞的增殖,有效加强了T细胞对肿瘤的浸润,改善了在aPD-L1单独使用时处于抑制状态的肿瘤微环境,从而大幅增强了aPD-L1的治疗效果。
此项研究进一步评估了PTT+aPD-L1组的细胞分泌的肿瘤坏死因子α(TNF-α)和干扰素γ(IFN-γ)水平,发现这些炎症性细胞因子的水平显著提高,表明了该组合策略能够通过CD4+ T细胞分泌的细胞因子触发更强的系统性免疫应答以对抗肿瘤。
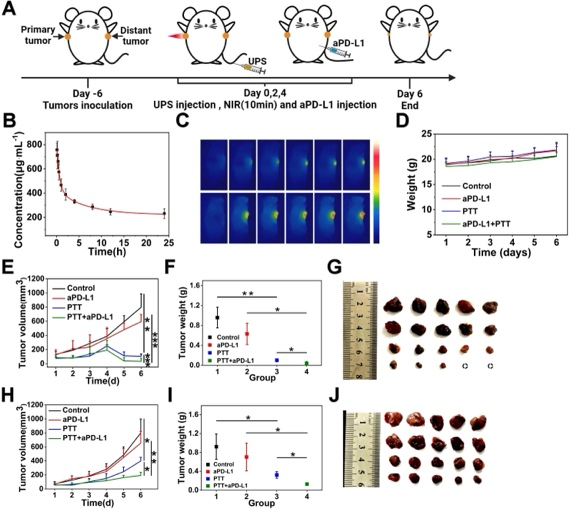
图5:UPS纳米颗粒的体内药代动力学和光热效应增强aPD-L1免疫疗法
结论:
本研究介绍了一种名为UPS(USPIO-PEG-SLex)的纳米诊疗剂,旨在通过靶向光热疗法增强抗PD-L1免疫治疗,以对抗免疫治疗的抵抗性。UPS纳米颗粒在体外和体内展示了显著的光热效能,并激活了与免疫相关的途径,当与抗PD-L1治疗结合时,显著增加了T细胞的浸润和细胞因子的分泌。这种组合显著抑制了肿瘤生长,表明UPS介导的光热疗法能有效增强抗PD-L1免疫治疗的效果,为克服免疫治疗抵抗提供了一种有前景的方法。
.
参考文献:
Li T.,Guo L.S.,Li J.X.et.al.,Precision USPIO-PEG-SLexNanotheranostic Agent Targeted Photothermal Therapy for Enhanced Anti-PD-L1 Immunotherapy to Treat Immunotherapy Resistance.,Int.J.Nanomedicine,2024,19,1249-1272.
.