机械敏感PIEZO1离子通道调控T淋巴细胞抗肿瘤细胞毒性

研究背景:
免疫检查点阻断(ICB)疗法为治疗包括转移性黑色素瘤、非小细胞肺癌及肾癌在内的多种癌症提供了有前景的治疗方案。尽管这种治疗方法展示了显著的治疗潜力,但其临床效果常因疗效有限而受到抑制,导致患者频繁复发。为克服基于ICB的疗法存在的瓶颈,进一步了解T细胞在免疫反应中的作用与调控机制成为了迫切需要。
目前,一个新兴的研究领域聚焦于T细胞的机械生物学,即探究T细胞如何感知及响应生物力学环境。迄今为止,已经发现了多个T细胞的生物力学传感器。一般而言,T细胞能识别并转导机械信号到下游生化反应中,引发T细胞的激活或抑制,从而调节其细胞毒性。在免疫突触中,细胞毒性T细胞通过在目标细胞表面产生张力,增强穿孔素介导的孔洞形成,最终导致目标细胞的破坏。遇到硬化的癌细胞时,细胞毒性T细胞还可以增加牵引力,以此增强其细胞毒性作用
研究内容:
1.PIEZO1的细胞毒性调节作用:
研究发现,阻断T细胞中的PIEZO1可以显著增强它们的牵引力,这一发现指示PIEZO1不仅作为细胞的机械感应器,还在调节T细胞对肿瘤细胞施加的力中发挥关键作用。
进一步的实验显示,PIEZO1的抑制增强了T细胞的细胞毒性能力,这表明PIEZO1通过调节T细胞的物理力量对其抗肿瘤能力有直接影响。
2.PIEZO1信号转导的分子机制:
研究揭示了PIEZO1通过上调GRHL3来影响T细胞功能的分子机制。GRHL3作为一个转录因子,它的表达上调导致了E3泛素连接酶RNF114的表达增加。
RNF114与肌动蛋白(F-actin)的相互作用影响了T细胞的牵引力。具体来说,RNF114的上调导致肌动蛋白网络的重组,这一重组抑制了T细胞的牵引力,从而影响了它们的细胞毒性。
3.PIEZO1在癌症免疫治疗中的潜在应用:
在携带肿瘤的小鼠模型中,通过PIEZO1拮抗剂处理的T细胞显示出对肿瘤的更强渗透能力和更有效的肿瘤生长抑制作用。这为PIEZO1作为提高癌症免疫疗法效果的潜在靶标提供了实验依据。
研究还指出,高水平的GRHL3和RNF114在临床样本中与较差的预后相关,强调了通过调控PIEZO1信号通路来提高T细胞的抗肿瘤效果的潜力。
4.细胞力学与T细胞细胞毒性的关系:
通过细胞力学实验,表明T细胞在PIEZO1被抑制时施加在肿瘤细胞上的力增加,这与它们细胞毒性能力的增强一致。这一发现揭示了T细胞细胞毒性与其机械环境感知能力之间的直接联系,为理解免疫细胞如何在肿瘤微环境中调节其功能提供了新的视角。
这些研究内容不仅深入探讨了PIEZO1在T细胞抗肿瘤功能中的作用和调控机制,也为开发新型癌症免疫治疗策略提供了理论基础和实验依据。
创新点:
PIEZO1在T细胞中的新作用:研究首次揭示了PIEZO1在调节T细胞的牵引力和抗肿瘤细胞毒性中的关键作用,扩展了我们对PIEZO1作为机械感应器在免疫细胞功能调控中作用的认识。
PIEZO1在T细胞中的作用机制:研究通过详细的分子机制探究,揭示了PIEZO1通过调控转录因子GRHL3以及下游的E3泛素连接酶RNF114,进而影响肌动蛋白网络重组和T细胞牵引力的全新信号传导路径。这为理解T细胞在抗肿瘤免疫应答中的机械力学提供了重要视角。
提出了新的治疗靶点:通过动物实验验证了PIEZO1的抑制可以增强T细胞对肿瘤的攻击力,并抑制肿瘤生长,为癌症免疫治疗提供了潜在的新靶点。这一发现有望开拓免疫疗法的新策略,特别是对于那些对传统治疗方法耐药或无反应的癌症患者。
跨学科的研究方法:该研究将免疫学、细胞生物学和生物物理学等多个学科领域的研究方法和技术相结合,探索了T细胞机械力学与其抗肿瘤功能之间的联系。
数据展示:
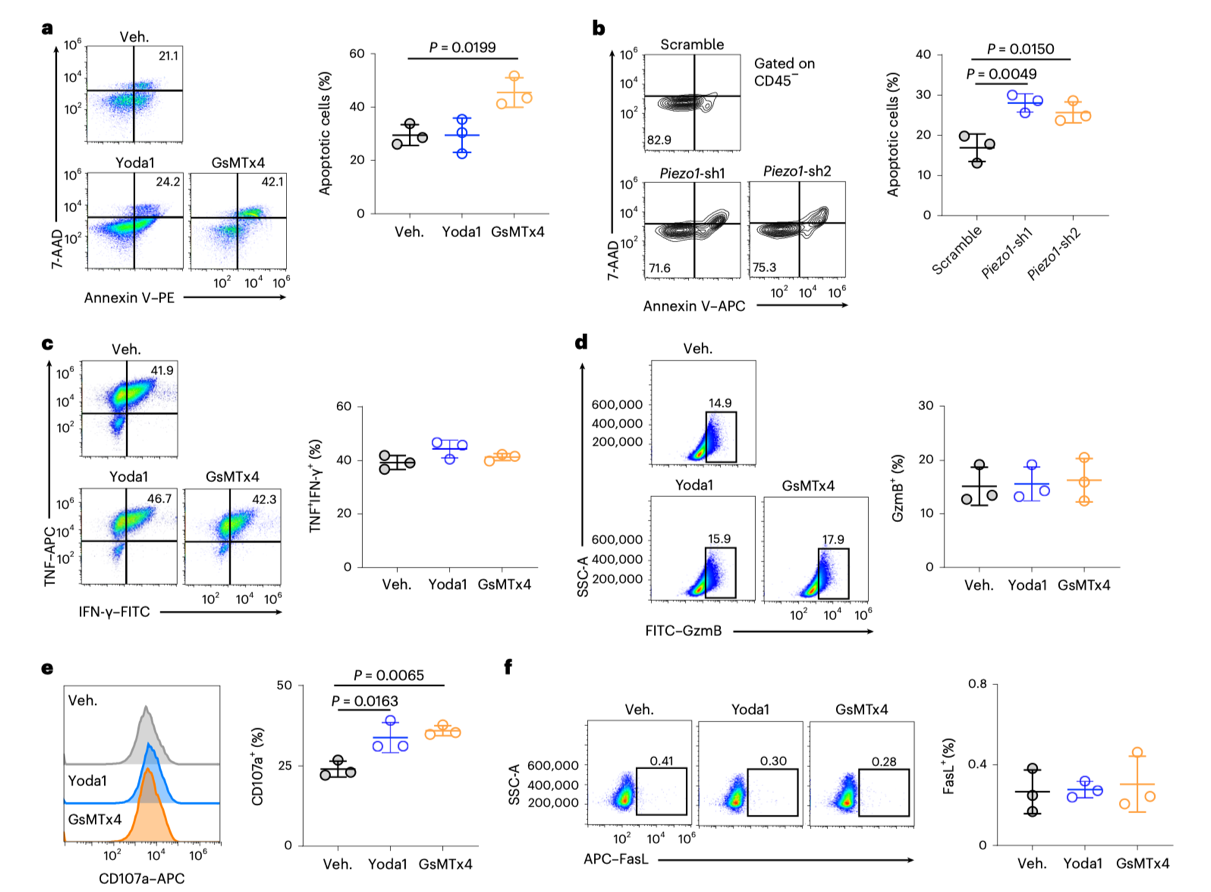
图1:阻断PIEZO1活性增强T细胞的杀伤功能

图2:阻断PIEZO1增强T细胞的牵引力

图3:阻断PIEZO1降低GRHL3的表达
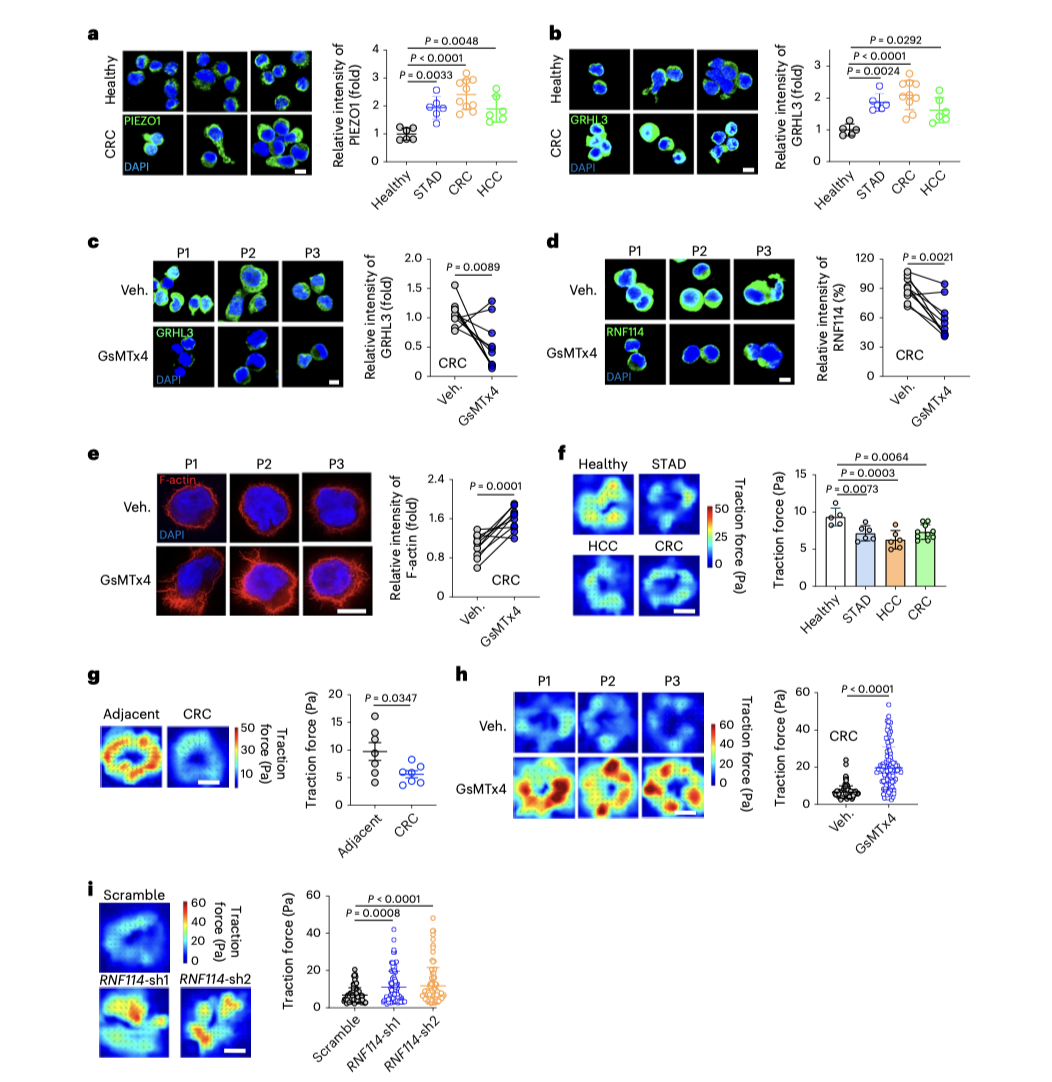
图4:T细胞的牵引力由PIEZO1–GRHL3–RNF114途径调节

图5:GRHL3或RNF114的表达与CD8+T细胞浸润以及对免疫治疗的总生存率在多种癌症中呈负相关