外泌体是一类直径在30-150 nm的细胞外囊泡,具有丰富的可检测靶标(蛋白质,DNA,RNA,脂质等)且非常稳定,可以作为细胞间信号转导的载体。外泌体不仅参与了细胞间通信,也影响了肿瘤的生长和转移,肿瘤微环境的改变,免疫调节等,在人类健康和疾病的许多方面起着重要作用。
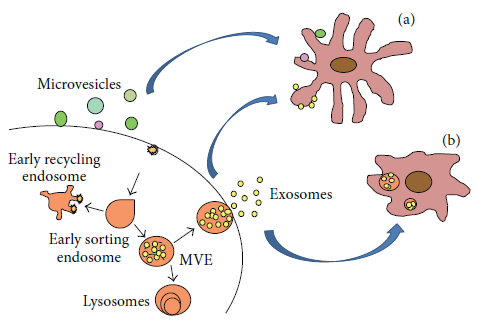
图1 外泌体从宿主细胞中释放并被受体细胞摄取。外泌体是宿主细胞中产生的多泡小体与细胞膜融合并释放到细胞外的小囊泡,可通过与细胞膜融合(a)或被胞吞(b)进入受体细胞【1】
外泌体提取常用的样本包括细胞培养上清及各种体液(血液、尿液等),针对这些样本发展起来的分离技术主要有:超速离心法、密度梯度离心法、超滤法、免疫磁珠法、沉淀法等,每种方法各有优缺点,如超速离心和密度梯度离心法提取的外泌体纯度较高,是现有提取方法的“金标准”,但离心设备贵且样本起始量大;而沉淀法虽可获得较多外泌体,但受杂蛋白影响,纯度较低。具体实验中应使用哪种提取方法,需要实验者根据实验条件及实验目的进行确定。
无论哪种外泌体分离方法都很难完全将外泌体与其他囊泡或大分子蛋白质复合体或其他杂质区分开,获得十分纯净而且单一的外泌体样品,因此就需要证明分离得到的产物是否是外泌体,即对外泌体进行鉴定。2014年国际细胞外囊泡协会(胞外囊泡和外泌体研究领域的研究者和科学家组成的专业社会团体,是胞外囊泡研究领域最权威的学会之一)提出了外泌体实验必须要做的最少实验要求,并于2018年进行了更新修改,即目前的《MISEV 2018》。
关于鉴定方法,除了利用透射电镜(TEM)鉴定形态、粒径分析(Nanosight)鉴定粒径分布和浓度之外,还要结合Western Blot检测囊泡上的标志性蛋白,三者缺一不可。与14年版相比,《MISEV 2018》在检测标志蛋白方面提出了更详细的建议,需同时检测待测囊泡不同类型的蛋白,如跨膜蛋白(CD9、CD63、CD81等)、膜结合蛋白(TSG101、ALIX、HSP70等),同时强调了阴性对照在检测外泌体样本中的重要性【2】。
东纳生物拥有成熟的外泌体鉴定和检测技术平台,设备齐全,人员专业,
可以为客户提供以下 常规技术服务 与 特色标记服务。
服务内容
01外泌体的鉴定——透射电镜(TEM)
为确定分离、提取的“外泌体”是否有较典型的外泌体结构,需对其进行鉴定。外泌体在体液中通常为球形结构,但在电镜下观察常为杯状或茶托状,通过TEM能够直接鉴定出样品中“外泌体”的形态。
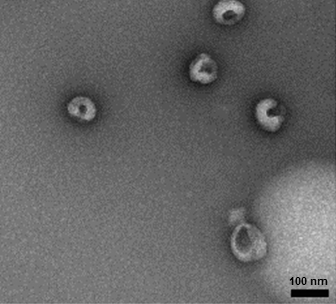
图2采用透射电镜观察从HCT116细胞培养基上清中分离出的外泌体【3】
02 外泌体的粒径分析(NTA)
检测提取后的样品大小是否在外泌体常规的粒径范围也是鉴定的关键。纳米微粒追踪分析术(NTA)可以实时检测外泌体的粒径区间,与之相配套的NTA分析软件计算出每例样品中外泌体颗粒数,最终得到整个体系的颗粒粒径分布和浓度信息,结合图表直观地得出结论,为外泌体的鉴定和定量提供了关键数据。
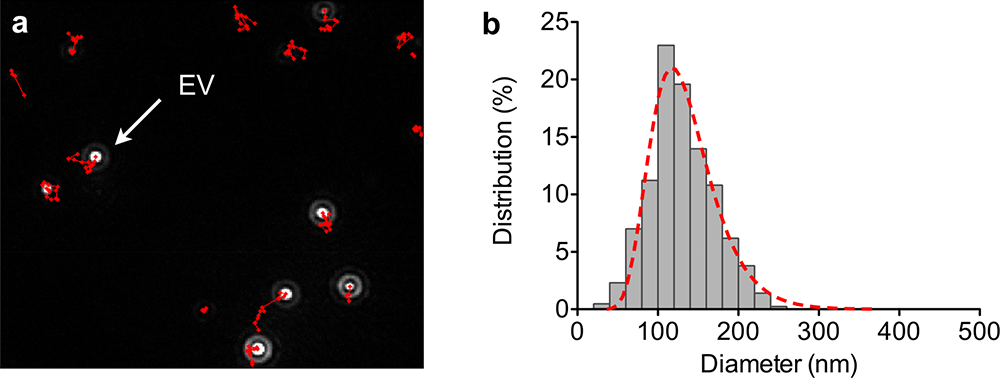
图3纳米微粒追踪分析(NTA)。(a)NTA对单个囊泡进行直接追踪观测 ;(b) NTA分析
软件根据对单个囊泡追踪观测的结果,进行粒径计算,得到整个体系的粒径分布及浓度信息 【4】
03外泌体的Western Blot检测及分析
按照《MISEV 2018》的要求,优选了外泌体跨膜蛋白(CD9、CD63、CD81等)、膜结合蛋白(TSG101、HSP70、ALIX等)、阴性对照(Calnexin)、内参(GAPDH、β-actin),可为客户提供外泌体常见的Western blot检测服务。
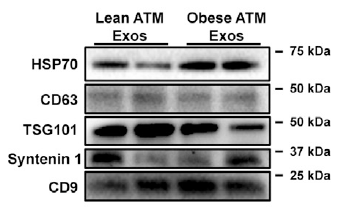
图4 Western Blot检测细胞外囊泡膜结合蛋白、跨膜蛋白等的表达情况 【5】
04外泌体的功能标记及检测
东纳生物拥有成熟的微纳米及分子标记技术,可实现对外泌体的荧光标记、磁性纳米颗粒标记、金纳米颗粒标记从而实现荧光成像、磁共振成像、暗场成像以及免疫电镜观察,可以进行5 mm磁性微球或荧光微球标记从而进行流式细胞仪检测,可以进行药物以及其它功能分子的负载从而实现载药外泌体的构建,还可以联合成像标记与载药从而实现基于外泌体的诊疗一体化系统。
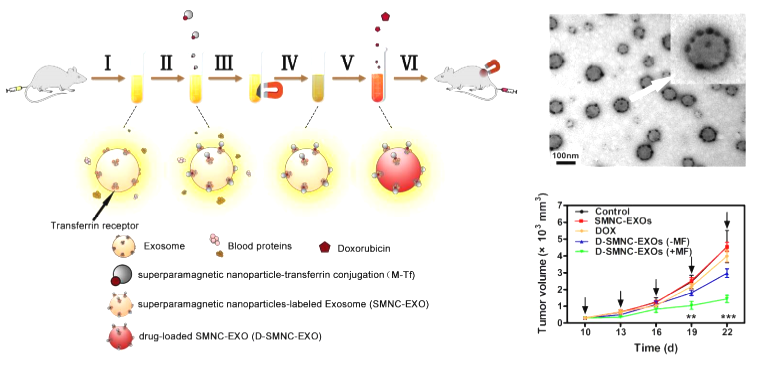
图5 采用转铁蛋白修饰的磁性纳米颗粒特异性标记外泌体,并进行磁分离提取和负载阿霉素,从而构建基于外泌体的磁共振成像和肿瘤治疗的诊疗一体化体系,实现转铁蛋白靶向和磁靶向的肿瘤治疗【6】
参考文献
【1】 Lin J, Li J, Huang B, et al. Exosomes: novel biomarkers for clinical diagnosis. Scientific World Journal. 2015; 2015:657086. doi:10.1155/2015/657086
【2】 Théry C, Witwer KW, Aikawa E, et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of extracellular vesicles. 2018; 7(1):1535750. doi:10.1080/20013078.2018.1535750
【3】 Jung M K, Mun J Y. Sample Preparation and Imaging of Exosomes by Transmission Electron Microscopy. Journal of Visualized Experiments. 2018; (131):e56482. doi:10.3791/56482.
【4】 Shao H, Im H, Castro CM, et al. New Technologies for Analysis of Extracellular Vesicles. Chemical reviews. 2018; 118(4):1917–1950. doi:10.1021/acs.chemrev.7b00534
【5】 Ying W, Riopel M, Bandyopadhyay G, et al. Adipose Tissue Macrophage-Derived Exosomal miRNAs Can Modulate In Vivo and In Vitro Insulin Sensitivity. Cell. 2017; 171(2): 372-384. doi: 10.1016/j.
【6】 Qi H, Liu C, Long L, et al. Blood Exosomes Endowed with Magnetic and Targeting Properties for Cancer Therapy. ACS Nano. 2016 ; 10(3):3323-33. doi: 10.1021/acsnano.5b06939.
“助力科研创新,帮助客户成功”