随着分子生物学和基因操控等技术的发展,已经发现有很多核酸类药物(例如寡核苷酸、质粒DNA、siRNA等)能够用于多种疾病的治疗。然而由于核酸类药物分子不够稳定,凭借自身的特性难以进入靶向组织或细胞,往往在体内还未到达相应病变组织就会分解失去药效,使其在临床上的使用受到了极大的限制。
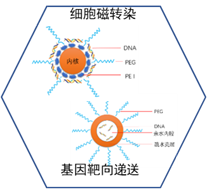
东纳生物通过纳米载体与核酸的结合开发了基因磁转染与递送平台,很好的解决了核酸在体内易分解的问题。细胞磁转染及基因靶向递送纳米载体,粒径小于100 nm,表面包被具有生物相容性的PEG(聚乙二醇)分子层。小尺寸的纳米载体通过极大的比表面积可以吸附更多的核酸分子,或者通过纳米载体内部空腔包载核酸,从而可以有效的保护核酸分子在体内长时间的循环、不被降解,并通过EPR效应(纳米载体对肿瘤增强的渗透和滞留效应)被动靶向到肿瘤组织,同时,还有可以在外层偶联上具有靶向作用的抗体、多肽、适配体等使其可以更加精准的达到相关病变组织。
东纳生物可以提供两种类型的核酸递送纳米载体构建方案:表面吸附型纳米载体(内核可以是脂溶性高分子,或磁性纳米颗粒等功能材料,可以负载脂溶性药物;PEG表面可以修饰抗体等靶向分子);与内腔包载型纳米载体(内腔可以包载水溶药物与核酸;疏水高分子壳层可以负载脂溶性药物;PEG表面可以修饰抗体等靶向分子)。